
Alüminium oksid
Alüminium oksid, Al2 O3 — alüminium və oksigenin kimyəvi birləşməsidir. Bir neçə alüminium oksid arasında ən çox rast gəlinən alüminium (III) oksid təyin edilmişdir. Ümumiyyətlə, alümina adlanır və ayrıca müəyyən forma və ya tətbiqlərə görə aloksid, aloksit və ya alundum da adlandırıla bilər. Təbii olaraq kristal polimorf fazasında α-Al2O3 mineral korund kimi meydana gəlir ki, bu da qiymətli daşlar yaqut və safirdir. Al2O3, sərtliyi sayəsində aşındırıcı və yüksək ərimə nöqtəsi sayəsində odadavamlı bir material olaraq alüminium metalının istehsalında əhəmiyyətlidir.
== Təbiətdə ==
Korund alüminium oksidin ən çox yayılmış təbii olaraq meydana gələn kristalformasıdır. Yaqut və sapfir korundun qiymətli keyfiyyətli formalarıdır. Yaqutlara xarakterik tünd qırmızı rəng və lazer keyfiyyəti xrom izləri ilə verilir. Safirlər dəmir və titan kimi fərqli rənglərdə olur. Son dərəcə nadir bir δ forması, deltalumit mineralı kimi meydana gəlir.

Azot-1 oksid
Azot-1 oksid duz əmələ gətirməyən oksiddir
== Tarixi ==
Diazot-monoksid və ya azot 1-oksid (N2O) ilk dəfə 1772-ci ildə Cozef Pristli tərəfindən alınmışdır və onu azaldılmış azot havası adlandırmışdır. Texniki adı şadlandırıcı-şənləndirici qazdır. Bu da onun keyləşdirici xüsusiyyətə malik olması ilə əlaqədardır. Tərkibində N2O olan hava ilə tənəffüs etdikdə əvvəlcə oyadıcı təsir göstərir, sonra isə keyləşmə baş verir. N2O-nun keyləşdirici təsirini ilk dəfə 1799-cu ildə məşhur ingilis alimi H. Devi müəyyən etmişdir. Belə ki, N2O qarışmış hava ilə tənəffüs etdikdə diş ağrısı aradan qalxır. Devinin bununla bağlı bir çox maraqlı təcrübələri var. Bundan yarım əsr sonra 1844-cü ildə amerikalı diş həkimi X. Uells dişlərin çıxarılmasında N2O- dan ağrıkəsici vasitə kimi istifadə etmişdir. Hazırda diazot-oksidindən miokard (ürəyin əzələ qişası) infarktının əməliyatında ağrıkəsici kimi (80% N2 və 20% O2) istifadə edilir.
== Xassələri ==
N2O rəngsiz, xoşagələn zəif iyli, şirintəhər qazdır.

Azot oksidləri
Azot oksidləri — N2 rəngsiz, iysiz və dadsız qazdır, havadan bir az yüngüldür. Oksigenə nisbətən suda az həll olur: 20°C-də (0,1 MPa) 1 l suda 15,4 ml azot həll olur. 0,1 MPa təzyiqdə və -196°C-də azot mayeləşir.
== Molekul quruluşu ==
N2 molekulunun quruluşu. Azot molekulunun quruluş formulu N ≡ N, elektron formulu isə : N ⋮⋮ N : kimidir. Molekulda üçqat rabitə çox davamlı rabitədir. Bu rabitələrdən biri σ -, ikisi isə π-rabitədir. Hər üç rabitənin elektron sıxlığı atomlar arasında simmetrik paylandığından N2 molekulu qeyri-polyardır.
=== Bor nitratı ===
Bor-nitrit (BN) 3000°C-də əriyir və bərkliyinə görə almaza oxşardır. Nitritlər ammonyakın alınması ilə hidrolizə uğrayır
== Azot oksidlərinin siyahısı ==
Azotun 8 oksidi N2O, NO, N2O3, NO2, N2O4, N2O5, NO3, N2O6 və 6 oksigenli turşusu məlumdur: H2N2O2, H2N2O3, H2NO2, HNO2, HNO3 və HNO4.

Bakı Oksford Məktəbi
Bakı Oksford Məktəbi (ing. Baku Oxford School) — Azərbaycan Respublikasının Bakı şəhərində ümumi təhsil müəssisəsi.
== Tarixi ==
1998-ci ildən fəaliyyət göstərir
== Fəaliyyəti ==
Bakı Oksford Məktəbi - Kembric Universitetinin imtahan mərkəzi və BMT yanında QHT-nın üzvüdür. Burada təhsil ingilis dilindədir. Təhsil müddəti 12 ildir. Məktəbi bitirənlərə aşağıdakı sənədlər verilir:
Oksford Dil Mərkəzinin ingilis dilini bilmə səviyyəsi haqqında sertifikat
Orta təhsil haqqında beynəlxalq attestat (İB və ya İQCSE)
Azərbaycan Respublikasının orta təhsil haqqında attestatıMəktəbin nəzdində Böyük Britaniya və digər ölkələrin universitetelərinə qəbul olunmaq üçün tələbələrin hazırlıq proqramı da fəaliyyət göstərir. Proqram Azərbaycanda təhsil üzrə Britaniya Şurasının dəstəyi ilə keçirilir. Qeyd edək ki, məktəbə qəbul olmaq istəyən şəxs ingilis dilindən test imtahanı verməlidir. Çünki burada təhsil ingilis dilindədəir. Əlavə dil olaraq isə şagirdin seçiminə görə ya fransız, ya da alman dili tədris olunur.
Bioloji oksidləşmə
Bioloji oksidləşmə – canlı hüceyrə və toxumalarda oksigenin sərfi ilə üzvi maddələrin parçalanması nəticəsində və karbon qazının ayrılması ilə gedən prosesdir.
== Bioloji oksidləşmə haqqında müasir nəzəriyələr ==
1774-cü ildə Fransız alimi A.Lavuazye müəyyən etdi ki, yanma maddələrin oksigenlə oksidləşməsindən ibarətdir. Başqa sözlə, tənəffüs yanma prosesi ilə eyniyyət təşkil edir. Bioloji oksidləşməyə dair bir sıra alimlər müxtəlif fikirlər irəli sürmüşdür. Məsələn, N.Sösürün, E.Saks, F.Şenbay, Van-Hoff və s. Bu alimlərin irəli sürdüyü fikirlər bioloji oksidləşmənin öyrənilməsində mühüm əhəmiyyət kəsb edir. F.Şenbayaya görə oksidləşmədə ozon iştirak edir. 1897-ci ildə toxumaların tənəffüsü bioloji oksidləşməyə dair ilk hipotez irəli sürüldü. Bu hipoteza peroksid nəzəriyyəsi adlanır. Bu hipotezanı bir-birindən aslı olmayaraq rus alimi A.N.Bax və alman alimi K.Engler hazırlamışdır.

Bismut oksid(II)
Bismut oksid(II)
Bismut monooksid – BiO formullu bismut metalı və oksigenin binar qeyri- üzvi birləşməsidir. Boz-qara rəngli kristallardır.Soyuq su ilə qarşılıqlı təsirdə olub, kristallohidrat əmələ gətirir.Ərimə temperaturu 902°C, qaynama 1647°C.
== Alınması ==
Bismut 3-oksidi bismutla qarşılıqlı təsirindən
B
i
2
O
3
+
B
→
3
B
i
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+B\rightarrow 3BiO}}}
Hidrogen ilə 265℃ temperaturda
B
i
2
O
3
+
H
2
→
2
B
i
O
+
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+H_{2}\rightarrow 2BiO+H_{2}O}}}
Karbon oksidi ilə 400℃ temperaturda
B
i
2
O
3
+
C
O
→
2
B
i
O
+
C
O
2
{\displaystyle {\mathsf {Bi_{2}O_{3}+CO\rightarrow 2BiO+CO_{2}}}}
== Kimyəvi xassələri ==
Havada qızdırıdıqda oksidləşir 180℃ temperaturda
4
B
i
O
+
O
2
→
2
B
i
2
O
3
{\displaystyle {\mathsf {4BiO+O_{2}\rightarrow 2Bi_{2}O_{3}}}}
Metala qədər300℃ temperaturda
B
i
O
+
H
2
→
2
B
i
+
H
2
O
{\displaystyle {\mathsf {BiO+H_{2}\rightarrow 2Bi+H_{2}O}}}
250℃ temperaturda
B
i
O
+
C
O
→
2
B
i
+
C
O
2
{\displaystyle {\mathsf {BiO+CO\rightarrow 2Bi+CO_{2}}}}
Turşularla turşu oksidləri ilə qarşılıqlı təsirdə olur.
3
B
i
O
+
6
H
C
l
→
2
B
i
C
l
3
+
B
i
+
3
H
2
O
{\displaystyle {\mathsf {3BiO+6HCl\rightarrow 2BiCl_{3}+Bi+3H_{2}O}}}
5
B
i
O
+
C
O
2
→
2
B
i
2
O
3
+
B
i
+
C
O
{\displaystyle {\mathsf {5BiO+CO_{2}\rightarrow 2Bi_{2}O_{3}+Bi+CO}}}
== Ədəbiyyat ==
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1.

Bismut oksid(III)
Bismut oksid(III)
Bismut oksid(III) – bismut metalı və oksigenin binar qeyri-üzvi birləşməsidir. Formulu Bi2O3 .Suda həll olmayan sarımtıl kristallardır.
== Alınması ==
Təbiətdə bismit mineralına rast gəlinir- Bi2O3 bismut oksidi.
Bismutun havada yanması ilə (500-1000℃)
4
B
i
+
3
O
2
→
2
B
i
2
O
3
{\displaystyle {\mathsf {4Bi+3O_{2}\rightarrow 2Bi_{2}O_{3}}}}
•Bismut nitratın parçalanmasından (700℃)
4
B
i
(
N
O
3
)
3
→
2
B
i
2
O
3
+
12
N
O
2
+
3
O
2
{\displaystyle {\mathsf {4Bi(NO_{3})_{3}\rightarrow 2Bi_{2}O_{3}+12NO_{2}+3O_{2}}}}
•Bismut sulfidin oksidləşməsindən(400℃)
2
B
i
2
S
3
+
9
O
2
→
2
B
i
2
O
3
+
6
S
O
2
{\displaystyle {\mathsf {2Bi_{2}S_{3}+9O_{2}\rightarrow 2Bi_{2}O_{3}+6SO_{2}}}}
== Fiziki xassələri ==
Bismut oksidi (III) ağ-sarımtıl kristallardır.Dörd kristallik modifikasiyası var:
alfa - Bi2O3 monoklin sinqoniya (psevdorombik), havada 727°C qızdırdıqda oksigeni itirir və omeqa - Bi2O3-x keçir.
beta - Bi2O3, parlaq sarı kristal, tetraqonal sinqoniya 646°C qədər soyudulduqda omeqa - Bi2O3- dən əmələ gəlir, 620-605°C-də alfa- Bi2O3 keçir.
qamma - Bi2O3 parlaq sarı kristaldır, kubşəkilli sinqoniyaya malikdir.
siqma - Bi2O3, narıncı kristallardır, kubşəkilli sinqoniyaya malikidir.
== Kimyəvi xassələri ==
qatı, isti turşularla reaksiyaya girir.(70-80℃)
B
i
2
O
3
+
6
H
C
l
→
2
B
i
C
l
3
+
3
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+6HCl\rightarrow 2BiCl_{3}+3H_{2}O}}}
xlorla reaksiyaya girir.
B
i
2
O
3
+
2
C
l
2
→
2
B
i
O
C
l
+
C
l
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+2Cl_{2}\rightarrow 2BiOCl+Cl_{2}O}}}
Molekulyar hidrogen metala qədər reduksiya edir.(240-270℃)
B
i
2
O
3
+
3
H
2
→
2
B
i
+
3
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+3H_{2}\rightarrow 2Bi+3H_{2}O}}}
Peroksidlərlə qarşılıqlı təsirdən bismutatlar əmələ gətirir.
(450-600℃)
2
B
i
2
O
3
+
2
N
a
2
O
2
+
O
2
→
4
N
a
B
i
O
3
{\displaystyle {\mathsf {2Bi_{2}O_{3}+2Na_{2}O_{2}+O_{2}\rightarrow 4NaBiO_{3}}}}
(400-500℃)
B
i
2
O
3
+
2
N
a
2
O
2
+
2
N
a
O
H
→
2
N
a
3
B
i
O
4
+
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+2Na_{2}O_{2}+2NaOH\rightarrow 2Na_{3}BiO_{4}+H_{2}O}}}
== Ədəbiyyat ==
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др..

Bismut oksid (II)
Bismut oksid(II)
Bismut monooksid – BiO formullu bismut metalı və oksigenin binar qeyri- üzvi birləşməsidir. Boz-qara rəngli kristallardır.Soyuq su ilə qarşılıqlı təsirdə olub, kristallohidrat əmələ gətirir.Ərimə temperaturu 902°C, qaynama 1647°C.
== Alınması ==
Bismut 3-oksidi bismutla qarşılıqlı təsirindən
B
i
2
O
3
+
B
→
3
B
i
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+B\rightarrow 3BiO}}}
Hidrogen ilə 265℃ temperaturda
B
i
2
O
3
+
H
2
→
2
B
i
O
+
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+H_{2}\rightarrow 2BiO+H_{2}O}}}
Karbon oksidi ilə 400℃ temperaturda
B
i
2
O
3
+
C
O
→
2
B
i
O
+
C
O
2
{\displaystyle {\mathsf {Bi_{2}O_{3}+CO\rightarrow 2BiO+CO_{2}}}}
== Kimyəvi xassələri ==
Havada qızdırıdıqda oksidləşir 180℃ temperaturda
4
B
i
O
+
O
2
→
2
B
i
2
O
3
{\displaystyle {\mathsf {4BiO+O_{2}\rightarrow 2Bi_{2}O_{3}}}}
Metala qədər300℃ temperaturda
B
i
O
+
H
2
→
2
B
i
+
H
2
O
{\displaystyle {\mathsf {BiO+H_{2}\rightarrow 2Bi+H_{2}O}}}
250℃ temperaturda
B
i
O
+
C
O
→
2
B
i
+
C
O
2
{\displaystyle {\mathsf {BiO+CO\rightarrow 2Bi+CO_{2}}}}
Turşularla turşu oksidləri ilə qarşılıqlı təsirdə olur.
3
B
i
O
+
6
H
C
l
→
2
B
i
C
l
3
+
B
i
+
3
H
2
O
{\displaystyle {\mathsf {3BiO+6HCl\rightarrow 2BiCl_{3}+Bi+3H_{2}O}}}
5
B
i
O
+
C
O
2
→
2
B
i
2
O
3
+
B
i
+
C
O
{\displaystyle {\mathsf {5BiO+CO_{2}\rightarrow 2Bi_{2}O_{3}+Bi+CO}}}
== Ədəbiyyat ==
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1.

Bismut oksid (III)
Bismut oksid(III)
Bismut oksid(III) – bismut metalı və oksigenin binar qeyri-üzvi birləşməsidir. Formulu Bi2O3 .Suda həll olmayan sarımtıl kristallardır.
== Alınması ==
Təbiətdə bismit mineralına rast gəlinir- Bi2O3 bismut oksidi.
Bismutun havada yanması ilə (500-1000℃)
4
B
i
+
3
O
2
→
2
B
i
2
O
3
{\displaystyle {\mathsf {4Bi+3O_{2}\rightarrow 2Bi_{2}O_{3}}}}
•Bismut nitratın parçalanmasından (700℃)
4
B
i
(
N
O
3
)
3
→
2
B
i
2
O
3
+
12
N
O
2
+
3
O
2
{\displaystyle {\mathsf {4Bi(NO_{3})_{3}\rightarrow 2Bi_{2}O_{3}+12NO_{2}+3O_{2}}}}
•Bismut sulfidin oksidləşməsindən(400℃)
2
B
i
2
S
3
+
9
O
2
→
2
B
i
2
O
3
+
6
S
O
2
{\displaystyle {\mathsf {2Bi_{2}S_{3}+9O_{2}\rightarrow 2Bi_{2}O_{3}+6SO_{2}}}}
== Fiziki xassələri ==
Bismut oksidi (III) ağ-sarımtıl kristallardır.Dörd kristallik modifikasiyası var:
alfa - Bi2O3 monoklin sinqoniya (psevdorombik), havada 727°C qızdırdıqda oksigeni itirir və omeqa - Bi2O3-x keçir.
beta - Bi2O3, parlaq sarı kristal, tetraqonal sinqoniya 646°C qədər soyudulduqda omeqa - Bi2O3- dən əmələ gəlir, 620-605°C-də alfa- Bi2O3 keçir.
qamma - Bi2O3 parlaq sarı kristaldır, kubşəkilli sinqoniyaya malikdir.
siqma - Bi2O3, narıncı kristallardır, kubşəkilli sinqoniyaya malikidir.
== Kimyəvi xassələri ==
qatı, isti turşularla reaksiyaya girir.(70-80℃)
B
i
2
O
3
+
6
H
C
l
→
2
B
i
C
l
3
+
3
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+6HCl\rightarrow 2BiCl_{3}+3H_{2}O}}}
xlorla reaksiyaya girir.
B
i
2
O
3
+
2
C
l
2
→
2
B
i
O
C
l
+
C
l
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+2Cl_{2}\rightarrow 2BiOCl+Cl_{2}O}}}
Molekulyar hidrogen metala qədər reduksiya edir.(240-270℃)
B
i
2
O
3
+
3
H
2
→
2
B
i
+
3
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+3H_{2}\rightarrow 2Bi+3H_{2}O}}}
Peroksidlərlə qarşılıqlı təsirdən bismutatlar əmələ gətirir.
(450-600℃)
2
B
i
2
O
3
+
2
N
a
2
O
2
+
O
2
→
4
N
a
B
i
O
3
{\displaystyle {\mathsf {2Bi_{2}O_{3}+2Na_{2}O_{2}+O_{2}\rightarrow 4NaBiO_{3}}}}
(400-500℃)
B
i
2
O
3
+
2
N
a
2
O
2
+
2
N
a
O
H
→
2
N
a
3
B
i
O
4
+
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+2Na_{2}O_{2}+2NaOH\rightarrow 2Na_{3}BiO_{4}+H_{2}O}}}
== Ədəbiyyat ==
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др..

Bismut oksid (V)
Bismut oksid (V)
Bi2O5 formullu bismut pentaoksid – bismut metalı və oksigenin binar qeyri- üzvi birləşməsidir. Suda həll olmur.
== Alınması ==
Qələvi mühitdə bismut oksidin xlorla oksidləşməsi ilə
B
i
2
O
3
+
C
l
O
2
+
4
K
O
H
→
B
i
2
O
5
+
4
K
C
l
+
2
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+ClO_{2}+4KOH\rightarrow Bi_{2}O_{5}+4KCl+2H_{2}O}}}
Qələvi məhlulda bismut oksidi suspenziyasının elektrolizi ilə
Bi2O3+ H2O □(→┬KOH ) Bi2O5↓ +2H2↑
== Fiziki xassələri ==
Bismut oksidi(V) qəhvəyi çalarlı qırmızı kristallardır. Suda həll olmur.Sulu məhluldan Bi2O5•n H2O hidrat şəklində çökür.
== Kimyəvi xassələri ==
Qızdırdıqda parçalanır.2 Bi2O5 n(→┴(350℃) ) 2Bi2O4 + O2↑
Hidrat qızdırdıqda susuzlaşır.Bi2O5• n H2On( →┴(120℃) ) Bi2O5 + n H2O
Turş mühitdə güclü oksidləşdiricidir.Bi2O5 + 10HCl n(→┴(T ) ) 2 BiCl3 +2Cl2↑ + 5H2O
Qələvi ilə qarşılıqlı təsirdə olur.Bi2O5 + 2 NaOH → 2 NaBiO3 + H2O
== Ədəbiyyat ==
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.

Bor oksidi
Bor oksidi–B2O3 – bor turşusunun anhidridi , rəngsiz , şüşəvari və ya kristallik, acı dada malik dielektrikdir. Şüşəvari təbəqəli quruluşa malikdir. ( təbəqələr arasındakı məsafə 0,185 nm).B2O3 kristallik maddədir , 450ºC-də əriyir, 2250ºC-də qaynayır, ərintini soyutduqda şüşəyəbənzər faza əmələ gəlir. Şüşə halında B2O3 polimerdir, quruluşunda mərkəzdə B və təpələrdə O atomları olan üçbucaq fraqmentlər yerləşir.
== Xassələri ==
B2O3 hiqroskopikdir.Su ilə əvvəlcə ümumi formulu (HBO2)n olan müxtəlif metaborat turşuları əmələ gəlir.Sonrakı sulaşma orta borat turşusunun H3BO3 əmələ gəlməsinə səbəb olur. Ərimiş B2O3 bir çox elementlərin oksidlərini yaxşı həll edir.Metal oksidləri ilə borat duzları əmələ gətirir. B2O3 turşu anhidrididir, çox zəif amfoterlik əlamətləri var.
Bor oksidinin 1000°C yüksək temperaturda elementar borla qızdırdıqda, buxarda termiki davamlı O=B-B=O xətti molekulu mövcuddur. Buxarın 300°C-dən aşağı temperatura sürətli soyutsaq müəyyən ərimə temperatur nöqtəsinə malik olmayan (B2O2)n ağ bərk polimeri əldə etmək olar.60 min atmosfer təzyiq altında və 1500°C temperaturda bor oksidi elementar borla aşağıdakı reaksiya ilə qarşılıqlı təsirə girir.Bu bor oksidi qrafit kimi təbəqəli quruluşa malikdir.
== Alınması ==
Ən təmiz bor borhidroksidin pirolizi ilə alınır.

Dəmir (II) oksid
Dəmir (II) oksidi - dəmir (II) və oksigenin mürəkkəb qeyri-üzvi birləşməsidir. Təbiətdə vüstit mineralı kimi mövcuddur.
== Fiziki xassələri ==
Dəmir (II) oksid – qara rəngdə bərk birləşmədir. Yalnız yüksək temperaturda sabit vəziyyətdə olur.
== Alınması ==
Dəmir (III) oksidin hydrogen ilə reduksiyaedici reaksiyası zamanı almaq olar:
Fe2O3 + 3H2 → 2FeO + 3H2O
Dəmir (III) oksidin dəm qazı ilə reduksiyaedici reaksiyası zamanı:
Fe2O3 + CO → 2FeO + CO2Dəmir(III) oksidin dəmir ilə reaksiyası zamanı:
Fe2O3 + Fe → 3FeO
Dəmirin oksigenlə aşağı təzyiq altında qızdırılması zamanı:
2Fe + O2 → 2FeO
Dəmir oksalatın vakuumda parçalanması zamanı:
FeC2O4 →t FeO + CO↑ + CO2↑
== Kimyəvi xassələri ==
Dəmir (II) oksid reaksiya zamanı əsası xassələr görsədir. Suda həll olunmur, oksidləşməyən turşularda asanlıqla həll olunur:
FeO + 2HCl → FeCl2 + H2O
Reduksiyaedici xassələr görsədir:
FeO + 4HNO3 → NO2 + Fe(NO3)3 + 2H2O
Dəmir(II) oksidin oksigenlə oksidləşmə reaksiyası:
4FeO + 3O2 → 2Fe2O3Natriun hidroksidlə birgə əriməsı reaksiyası
FeO + 4NaOH →Na4FeO3 + 2H2O
Oksigenlə reaksiyası:
4FeO + 2nH2O + O2 → 2(Fe2O3 ⋅ nH2O)
6FeO + O2 →300−500 0C 2Fe3O4Hidrogen sulfid ilə reaksiyası:
FeO + H2S →500 0C FeS + H2O
== Tətbiqi ==
Keramika və mineral boyaların tərkib hissəsi kimi istifadə olunur. E172 nömrəsi altında qida rəngi kimi qida sənayesində geniş istifadə olunur.
== Toksikliyi ==
Dəmir (II) oksidi zəhərli deyil. Buna baxmayaraq, dəmir (II) oksidin aerozollarına (toz, tüstü) uzun müddət məruz qaldıqdan sonra ağciyərlərdə çökür və pnevmokoniozun bir növü olan sideroza səbəb olur.
== Mənbə ==
Волков А. И., Жарский И. М. Большой химический справочник.
Fosfor oksidi (V)
4P + 5O2 ---2P2O5
Fosfor (V) oksidkimyəvi xassələrinə görə digər turşu oksidlərinə oxşayır. Temperaturdan və götürülən suyun miqdarından asılı olaraq müxtəlif turşular alınır.
P2O5 + H2O ---0*C 2HPO3
P2O5 + 2H2O---20*C H4P2O7
P2O5+ 3H2O---100*C 2H3PO4
P2O5 suuducu xassəyə malikdir. Məsələn,o nitrat tuşusunu N2O5-ə,perxlorat turşusunu isə Cl2O7-Yə çevirir.

Fosfor oksidləri
Fosfor oksidləri — Fosfor azot kimi yeddi müxtəlif oksid əmələ gətirir. Bu oksidlərdən ikisi: fosfor (III) oksid P2O3 və fosfor (V) oksid P2O5 hərtərəfli öyrənilmişdir. Fosfor (III) və (V) oksidin bir ümumi xüsusiyyəti vardır: onlar hətta buxar halında da dimer formasında olur. Yəni bu oksidlərin həqiqi formulları P4O6 və P4O10 kimidir. Onların daha sadə emprik formulları P2O3 və P2O5 kimi göstərilir. Fosfor (III) oksid ağ rəngli, zəhərli, kristal maddədir. İşıqda davamsızdır, əvvəl saralır, sonra isə qızarır. Bu fosfor (III) oksidin qismən parçalandığını və reaksiya məhsullarından birinin qırmızı fosfor olmasını göstərir. Qızdırdıqda disproporsiyalaşır. Fosfor oksidləşdikdə oksigen çatışmırsa fosfor (III) oksid əmələ gəlir.

Germanium oksid (IV)
Germanium - oksidi (IV)
Germanium oksidi (IV) (germanium dioksid) germanium və oksigenin binar qeyri - üzvi kimyəvi birləşməsi olub amfoter oksiddir. Kimyəvi formulu GeO2 . Germanium – dioksidin forması silisium dioksidə çox oxşardır. İki kristallik və üçüncü amor modifikasiya halında mövcuddur :
Heksoqonal β- GeO2 , α- kvars ilə eyni quruluşa malikdir.
Tetraqonal α- GeO2 ( mineral forma argutit) SnO2 tipli struktura malikdir. Yüksək təzyiq altında CaCl2 tipli rombik formaya keçir.
Amorf GeO2 şüşəvari kvarsa bənzəyir, suda həll olandır.Tetraqonal germanium dioksid 1033°C -də heksoqonal formaya keçir. ∆Hα→ β=21,6kC/mol
== Alınması ==
Germanium dioksidi GeCl4 hidrolizə uğradıb, alınan çöküntünün 900°C-də qurutmaqla alınır.Bu zaman adətən amorf və heksoqonal GeO2 qarışığı alınır.
GeCl4+ H2O → m GeO2• n H2O + 4HCl↑ □(→┴(900°C) ) GeO2+ H2O↑
700°C-dən yuxarı temperaturda germaniumu oksidləşdirməklə
Ge + O2 □(→┴(˃700°C) ) GeO2
Germanium sulfidin (IV) qaynayan suda hidrolizi ilə alınır.
GeS2 + 2H2O □(→┴(100°C) ) GeO2↓+ 2H2S↑
Germaniumun durulaşdırılmış nitrat turşusunda həll etməklə.
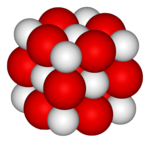
Kalsium-oksid
Əsasi oksiddir, turşu oksidləri və turşularla qarşılıqlı təsirdə olur.
1.CaO+CO2 → CaCO3
2.CaO+SO3 → CaSO4
3.CaO+H2SO4→ CaSO4+H2O
4.CaO+2HCl → CaCl2+H2OOnu sənayedə əhəngdaşının parçalanmasından alırlar.
CaCO3→ CaO+CO2 ↑
CaO ağ rəngli, çətin əriyən (2570ºC temperaturda əriyir) maddədir. Onu su ilə reaksiyasından çoxlu istilik ayrılır. CaO-nun texniki adı “sönməmiş əhəng” olduğundan kalsium-oksidin su ilə qarşılıqlı təsirinə “əhəngin söndürülməsi” deyilir.
CaO+H2O→Ca(OH)2+Q
Kalsium –oksidin əsas etibarilə sönmüş əhəng Ca(OH)2, kalsium –karbid CaC2 almaq üçün istifadə edilir.

Kremni oksidi(IV)
SiO2 adi şəraitdə bərk halda olan, suda həll olmayan maddədir. Adi şəraitdə atom kristal qəfəsi əmələ gətirir və formulu (SiO2)n kimidir.

Manqan (III) oksid
Manqan (III) oksid - suda həll olmayan qeyri üzvi birləşmədir.
== Fiziki xassələri ==
Manqan (III) oksidi bir neçə modifikasiyada qəhvəyi-qara kristallar əmələ gətirir:
α-Mn2O3, rombik sinqoniya, kurnakit mineralı
β-Mn2O3, kuboid sinqoniya, mineral biksbiit
γ-Mn2O3, tetragonal sinongiya
== Alınması ==
Təbiətdə braunit, kurnakit və biksbiit mineralı kimi mövcuddur.
Manqan (III) oksidini oksidləşdirici-reduksiyaedici reaksiya zamanı almaq olar:2 MnO 2 + Zn → Mn 2O3 + ZnO
Manqan(II) oksidin oksidləşməsi zamanı alınır:4 MnO + O2 → 2 Mn2O3
Manqan(IV) oksidin reduksiyaedici reaksiyası zamanı alınır:2 MnO2 + H2 → Mn2O3 + H2O
== Kimyəvi xassələri ==
Manqan (III) oksidi qızdırıldıqda parçalanır:
6
M
n
2
O
3
→
950
−
1100
o
C
4
M
n
3
O
4
+
O
2
{\displaystyle {\mathsf {6Mn_{2}O_{3}\ {\xrightarrow {950-1100^{o}C}}\ 4Mn_{3}O_{4}+O_{2}}}}
6
M
n
2
O
3
→
300
−
600
o
C
,
v
a
c
u
u
m
4
M
n
3
O
4
+
O
2
{\displaystyle {\mathsf {6Mn_{2}O_{3}\ {\xrightarrow {300-600^{o}C,vacuum}}\ 4Mn_{3}O_{4}+O_{2}}}}
Hidrogenlə reduksiya edilir:
M
n
2
O
3
+
H
2
→
300
o
C
2
M
n
O
+
H
2
O
{\displaystyle {\mathsf {Mn_{2}O_{3}+H_{2}\ {\xrightarrow {300^{o}C}}\ 2MnO+H_{2}O}}}
M
n
2
O
3
+
2
A
l
I
3
→
2
M
n
I
2
+
A
l
2
O
3
+
I
2
↑
{\displaystyle {\mathsf {Mn_{2}O_{3}+2AlI_{3}\ {\xrightarrow {}}\ 2MnI_{2}+Al_{2}O_{3}+I_{2}\uparrow }}}
ub>OTurşularla reaksiya zamanı həm oksidləşdirici həm də reduksiyaedici xasissə göstərir:2Mn2O3 + 8HNO3 → 4Mn(NO3)2 + O2 + 4H2O
2M2О3 + H2SO4 → MnSO4 + MnO2↓+ 2H2O
Metal oksidləri ilə əridildikdə, manqanit duzları əmələ gətirir:Mn2O3 + ZnO → Zn[Mn2O4]
Mn2O3 + La2O3 → 2 La[MnO3]
Konsentrləşdirilmiş xlor turşusu ilə oksidləşdirici xüsusiyyətlərini göstərir:Mn2O3+ 6HCl → 2MnCl2 + Cl2↑ + 3H2O
== Mənbə ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007.

Maye oksigen
Maye oksigen – mavi rəngdə, şəffaf, yüngül hərəkətli, adi temperaturda tez buxarlanan mayedir.
== Fiziki — kimyəvi xassələri ==
Maye oksigen yanmır, lakin onun ətraf atmosferə müntəzəm şəkildə buxarlanması atmosferdəki oksigenlə birləşib, intensiv yanğın törədə bilər. 1 litr maye oksigen buxarlandıqda 140C-də 830l oksigen yaradır. Qaynama temperaturu 183;
sıxlıq – 1, 13 kq/m3
== Tətbiqi ==
Maye oksigeni adi havanın — 1940C qədər donduqda alınan maye havanın fraksiyalaşdırma ilə alınır. Maye oksigenin saxlanılması: reaktiv yanacaqların misal üçün spirtlərin və onların qarışığının oksidləşdiricisi kimi geniş istifadə olunur. Adətən isti izolyasiyası olan və yaxud müxtəlif həcmli(5–50m3), tank rezervuarlarda saxlanılır. Daxildəki şar şəklində olan rezervuar bürüncdən hazırlanır.buxarlanan oksigeni havaya ötürmək üçün maye oksigeni saxlayan rezervuarların atmosferə çıxışı olmalıdır. maye oksigen saxlanılan rezervuarların həcmi kiçik olarsa (1000–1200 l) buxarlanan oksigenin itkisi əvvəlki həcmdən saatda 0,5–0,7% təşkil edir. Açıq qablarda saxlandıqda izolyasiya olmadan oksigenin buxarlanması çox intensiv şəkildə dəqiqədə 1–3%-ə çatır. Həcmi 50m3 olan və izolyasiyası möhkəm olan rezervuarlarda saxlanan maye oksigenin itkisi sutkada 0,2%-ə bərabərdir.

Mis (II)oksid
Mis (II) oksidi (mis oksidi) CuO – iki valentli mis oksididir. Qara kristaldır, normal şəraitdə olduqca sabitdir, suda həll olunmur. Təbiətdə tenorit (melakonit) mineralı kimi mövcuddur.
== Alınması ==
Mis (II) oksidi havada metalik misi qızdırmaqla (1100 ° C-dən aşağı olan temperaturda) almaq olar:2Cu + O2 = 2СuОMis (II) hidroksidi, onun nitrat və ya karbonatını qızdırmaqla mis (II) oksidi almaq olar:2Cu(NO3)2 → 2CuO + 4NO2 + O2
CuCO3 → CuO + CO2
Cu(OH)2 → CuO + H2OMalaxiti qızdırmaqla CuO alınır:Cu2CO3(OH)2 →2CuO + CO2 + H2O
== Kimyəvi xassələri ==
Mis (II) oksid turşularla reaksiyaya qirərək mis (II) duzları və su əmələ qətirir:CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO qələvilərlə qarşılıqlı əritməklə kupratlar alınır:CuO + 2KOH → K2CuO2 + H2O
11000C qədər qızdırılıqda mis və oksigen alınır. Mis (II) oksidə yaxın qələn mis (II) hidroksid zəif qələvidir. Qələvilərin qatı məhlulu ilə reaksiya zamanı hidrokso-kupratlar əmələ gəlir.
Cu(OH)2 + 2NaOH → Na2 [Cu(OH)2]
== Fiziki xassələri ==
Mis (II) oksidi monoklin kristal sisteminə aiddir.
== Tətbiqi ==
CuO, yaşıl və mavi rəng vermək üçün şüşə istehsalında istifadə olunur. Bundan əlavə, mis oksid mis — yaqut şüşələrin istehsalında istifadə olunur. Mis(II) oksidi quru batareyalar hazırlamaq üçün istifadə edilə bilər.

Neftin oksigenli birləşmələri
Neftin oksigenli birləşmələrinə - turşular, fenollar, ketonlar, efirlər və laktonlar, həmçinin furan və anhidrid birləşmələri aiddir.
Neftin fraksiyalarının qaynama temperaturu artdıqca, oksigenli birləşmələrin də miqdarı artır.
Neftin oksigenli birləşmələrinin miqdarı onun geoloji yaşı və əlaqədə olduğu süxurun təbiəti ilə sıx surətdə əlaqədardır.
neftin oksigenli birləşmələri içərisində turşular və fenollar miqdarca daha çox olur. Bu birləşmələr turşu xassəsinə malik olduqlarına görə istər neftdən və istərsə də neft fraksiyalarından qələvilərin köməyilə ayrıla bilər. Onların ümumi miqdarı adətən turşu ədədi, yəni 1 q neft məhsuluna sərf olunana KOH-ın mq-la miqdarı ilə müəyyən edilir. Bütün oksigenli birləşmələr kimi, turşu xassəli maddələrin miqdarı da neft yatağının dərinliyi və yaşı artdıqca azalır.
İndiki dövrə qədər turşu və fenolların analitik ayrılma çətinliyi, neftin tərkibində onların hansı nisbətdə olması haqqında dəqiq məlumat verməyə imkan vermir.
Oksigenli birləşmələrdən neft turşuları daha çox öyrənilmişdir. "Neft turşuları" dedikdə, neftin tərkibinə daxil olan bütün alifatik, alitsiklik (naften), aromatik, hibrid quruluşlu turşular nəzərdə tutulur.

Neodim oksiddən istifadə
Neodim oksiddən istifadə
Neodim oksid (Nd2O3) neodim əlvan metalının havada qızdırılması yolu ilə əldə edilir ki, həmin hava bunun hesabına çox tez qızır və qeyri-metallarla - azot, halogenlər, kükürd, hidrogen və digərləri ilə reaksiyaya daxil olur.
Xarici görünüşü - mavi, refrakter toz.
Elementin bütün tərkib hissələrindən ən çox onun oksidi əhəmiyyət kəsb edir, hansı ki bir sıra fiziki-kimyəvi xüsusiyyətli üstünlüklərə malikdir:
-ərimə temperaturu - 2200° C;
-qaynama temperaturu - 3300° C;
-suda və orta güclü mineral turşularda həll olunur;
-asan higroskopik material;
-soyuq su, alkalilər və ammonium hidratla reaksiyaya daxil olmur.
Onun təmizliyi 99%, 99.9%, 99.99%, 99.999% təşkil edir.
== İstifadə ==
Neodim oksidin yaxşı xüsusiyyətlərinə görə, tətbiq sahəsi kifayət qədər genişdir. Hər şeydən çox keramika və şüşəəritmədə istifadə olunur. Neodim şüşəsi onun şüşə ərintilərinə daxil edilməsi yolu ilə əldə edilir. Belə şüşələr lazer və kosmik cihazlarda, yarımkeçirici lazerlərdə və inertial termoatom sintezi üçün multişüa sistemlərində istifadə olunur.
Neodim oksid dielektrik olaraq çox az genişlənmə əmsalı ilə istifadə olunur.
Onun istifadəsinə hətta gündəlik həyatda da rast gəlmək olar.

Oksalat turşusu
Oksalat turşusu (turşəng turşusu) – (etandion turşusu, kimyəvi formulu — C2H2O4 və ya HOOC-COOH) doymuş karboktsilik turşular sinfinə aid güclü kimyəvi üzvi turşudur.
Standart şəraitdə oksalat turşusu ağ kristal maddə olan iki əsaslı doymuş karbotksilik turşudur.
Oksalat turşusunun duzları və efirləri oksalatlar adlanır.
== Tarixi ==
Oksalat turşusu ilk dəfə 1824-cü ildə alman kimyaçısı Fridrix Völer tərəfindən disiandan sintez edilmişdir.
== Təbiətdə tapılması ==
Təbiətdə turşəng, rhubarb, karambola və bəzi digər bitkilərdə sərbəst formada və kalium və kalsium oksalatları şəklində olur.
== Alınması ==
Sənayedə oksalat turşusu karbohidratların, spirtlərin və qlikolların HNO3 və H2SO4 qarışığı ilə V2O5 iştirakında, və ya etilen və asetilenin HNO3 ilə PdCl2 və ya iştirakı ilə oksidləşməsi, həmçinin propilenin maye NO2 ilə oksidləşməsi ilə alırlar.
Turşəng turşusunun alınmasının perspektivli üsulu CO ilə NaOH-dan natrium formaitdan keçməklə alınmasıdır:
2HCOONa=NaOOC-COONa=HOOC-COOH(Oksalat turşusu)2HOOC-COOH+ 2Na= 2HOOC-COONa+H²(turş duz)HOOC-COOH+ 2NaOH= NaOOC-COONa+2H²O(Normal duz)Onun həmçinin aşağı temperaturda turşu mühitində asetilendən alınması da tətbiq olunur:
5C2H2 + 8 KmnO4 + 12H2SO4 → 5 HOOC–COOH + 8MnSO4 + 4K2SO4 + 12H2O
== Xassələri ==
Yanma entalpiyası (ΔH0yanma) −251,8 kJ/mol
Dekarboksilləşmə temperaturu 166–180 °C
== Tətbiqi ==
Laboratoriyalarda oksalat turşusu hidrogen xlorid və hidrogen yodid almaq üçün istifadə olunur:
Oksalat turşusu həmçinin xlor dioksidin laboratoriya sintezi üçün də istifadə olunur:
Oksalat turşusu və oksalatlar toxuculuq və dəri sənayesində mordant kimi istifadə olunur. Onlar metal örtüklərin — alüminium, titan və qalayların çökməsi üçün anod vannalarının komponentləri kimi xidmət edirlər.
Oksalat turşusu və oksalatlar analitik və üzvi kimyada istifadə olunan reagentlərdir. Onlar metal üzərində pas və oksid örtüklərini çıxarmaq üçün kompozisiyalara daxildir; məhluldan nadir torpaq elementlərinin çökdürülməsi üçün istifadə olunur.

Oksana Hətəmxanova
Oksana Hətəmxanova (29 iyun 1990) — Azərbaycanı təmsil edən üzgüçü.
== Həyatı ==
Oksana Hətəmxanova 1990-cı il iyunun 29-da anadan olub.
== Karyerası ==
Oksana Hətəmxanova Azərbaycanı 2008-ci ildə Çində baş tutan XXIX Yay Olimpiya Oyunlarında təmsil edib. Nəticədə 100 metr məsafəyə brass üsulula üzmə turnirnində 1:20.22 dəqiqə nəticə göstərdi və 46-cı pillənin sahibi olub.Daha sonra Oksana Hətəmxanova Azərbaycanı 2012-ci ildə Birləşmiş Krallıqın London şəhərində baş tutan XXX Yay Olimpiya Oyunlarında təmsil edib. Nəticədə 100 metr məsafəyə brass üsulula üzmə turnirnində 1:25.52 dəqiqə nəticə göstərdi və 44-cü pillənin sahibi olub.
