
Appel reaksiyası
Appel reaksiyası - spirtlərdən alkil xloridlərin və alkil bromidlərin tetraxlorid və ya tetrabromid və trifenilfosfin ilə qarşılıqlı təsirləri ilə sintezi metodudur:
Sintetik təcrübəyə 1970-ci illərdə Rolf Appel tərəfindən tətbiq edilmişdir [1].
== Reaksiya mexanizmi ==
Appel reaksiyası fosfinin tetrahalogenmetan ilə halogenofil reaksiyasına əsaslanır. Birinci mərhələdə, trixlorometil və ya tribrommetil qrupunun tetrahalogen metanın halogen atomunda fosfin 1 ilə ayrılan nukleofil əvəzetmə nəticəsində, əlavə - psevdofosfonium duzunun əmələ gəlməsi baş verir. haloform 3, sonra halofosfonium duzunun 4 alkolyat anionunun nükleofili əvəzlənməsi ilə duz 5 əmələ gəlir.
Son mərhələdə, psevdofosfonium duz 5-in karbonuna halogenid ionunun nükleofil hücumu baş verir, fosfin oksidin 7 xaric olmasına və alkil halogenid 6 əmələ gəlməsinə, çevrilməyə səbəb olan SN2 mexanizminə gətirib çıxaran nükleofil əvəzlənməsi baş verir. Nəticədə karbinol karbonunun konfiqurasiyası gedir:
Reaksiyanın son mərhələsinin arxasında duran qüvvə, sabitliyi P = O əlaqənin əmələ gəlməsinin yüksək (~ 544 kJ / mol) enerjisi sayəsində çox yaxşı bir ayrılma qrupu olan fosfin oksidinin meydana gəlməsidir.
== Tətbiqi ==
Appel reaksiyasının əsas üstünlüyü,onun mülayim və neytral şərtləridir, bu da spirt mühitində turşuluq xassəsi əks etdirən halogenlə əvəz olunan hidroksil qrupudur məsələn, hidrogen xlorid, tionil xloridin geraniolun geraniolxloridə çevrilməsi . Nəticədə fosfor xloridlərin izomerləşməsi və ayrılması ilə geranil və linalil xlorid qarışığının əmələ gəlməsin baş verir . Appel reaksiyası bu çatışmazlıqlardan məhrumdur. Appel reaksiyasında əsas çatışmazlıq- hədəf məhsulu olan stexiometrik miqdarda əmələ gələn fosfin oksiddən ayrılması zərurətidir, məsələn, kifayət qədər yüksək temperaturda distillə, termallabil halogenidlərin izomerləşməsinə və ya rasemizasiyasına və yenidən kristallizasiyaya səbəb ola bilər .
Ayvers reaksiyası
Ayvers reaksiyası- Qələvi və spirt məhlulu təsiri ilə kumarinlərin flavonollara çevrilməsi reaksiyasıdır
1908 ildə alman alimi Ayvers tərəfindən kəşf edilmişdir.
== Mənbə ==
С. Оаэ. Химия органических соединений серы. М.: Мир, 1975.
Н.К. Ляпина. Химия и физикохимия сераорганическихсоединений нефтяных дистиллятов. М.: Наука. 1984.
Т. Джилкрист, Р. Сторр. Органические реакции и орбитальная симметрия М.: Мир, 1976.

Barton reaksiyası
Barton reaksiyası - fotokimya,nitrosoalkonallarda alkil nitritlərin yenidən təşkili ikincisinin oksimlərə və ya dimerlərə çevrilməsidir:
burada R = H, Alk, Ar. Proses ümumiyyətlə təsirsiz bir p-həlledici və > 330 nm-də soyutma ilə həyata keçirilir. Alkil zənciri üçdən çox C atomunu və karbon atomundakı H atomunu əvəz edən reaksiyaya daxil olur. Sonuncunun H atomu yoxdursa, spirtlərin və karbonil birləşmələrin əmələ gəlməsi ilə nisbət pozğunluğu müşahidə olunur.
Barton, reaksiya sərbəst radikal mexanizminə görə davam edir və H atomunun alkoksi radikalında (f-la I) keçid vəziyyətindən (II) keçərək H atomunun hüceyrədaxili miqrasiya mərhələsini əhatə edir; nitro mürəkkəb III okside izomerləşir:
P-tion yalnız 6 üzvlü bir həlqənin meydana gəlməsinin mümkün olduğu hallarda problemsiz bir şəkildə davam edir. keçici vəziyyət. Başlanğıc nitritdəki karbon atomunun ikinci bir H atomu yoxdursa, nitroz birləşməsinin də dimeri yaranır.
Bartonun reaksiyası steroid molekullarının qeyri-aktiv bölgələrinə funksiyanı təqdim etmək üçün geniş istifadə olunur., xüsusən 18 və 19 mövqelərindəki metil qruplarında, məsələn:
Barton reaksiya məhsulları aralıq maddə olaraq istifadə olunur, politsikl sintezində. nitronlar, məsələn:
Reaksiya 1960.-cı ildə D.Barton tərəfindən kəşf edilmişdir.
== Mənbə ==
Г.О. Беккера, /Введение в фотохимию органических соединений,/.

Berdcelini reaksiyası
Berdcelini reaksiyası- 1906-cı ildə İtalyan kimyaçısı Guido Bardcellini tərəfindən kəşf edilən kimyəvi reaksiyadır. İlkin reaksiya, fenol, xloroform və aseton reaktivlərinin natrium hidroksid məhlulunun iştirakı ilə qarışığı idi. Bardcellini'nin araşdırmasından əvvəl, bu çoxkomponentli reaksiyaya (MCR) aid edilən məhsul, o zaman kimya mətnlərində bir fenol törəməsi olaraq xarakterizə edilmişdi. Bununla birlikdə, Bardcellini, karboksil turşu törəməsinin olduğunu nümayiş etdirdi
Daha sonra üzvi kimyaçılar bu reaksiyanı ketonlardan (xüsusən asetondan) və ya β-amino spirtlərdən yüksək dərəcədə maneəli və ya həcmli morfolin və ya piperazin əldə etmək üçün ümumi üzvi sintez metodu kimi istifadə etdilər və ya diaminlər.
== Tarix ==
Guido Bardcellini, eyni adda Fişer esterifikasiya reaksiyası ilə tanınan Alman kimyaçısı və Nobel mükafatçısı Herman Emile Louis Fişer-in tələbəsi idi. Badcellini doktorluq sonrası laboratoriya tədqiqatını Fişerin laboratoriyasında apardı. Karyerasının böyük bir hissəsində Roma Universitetində kimyaçı vəzifəsində çalışıb.
Bu yaxınlarda təcrid olunmuş birləşmə olan kumarinlərə olan marağı, Bardcellini'ni çoxkomponentli reaksiyalarla (MCR) sınaqdan keçirməyə sövq etdi. Natrium hidroksid məhlulunda fenollar, xloroform və aseton mühitində sınaqdan keçirdi. Tərkibini əks eydirən quruluşun əvvəllər düşündüyü kimi fenol əvəzinə karbon turşusu verdiyini tapdı.

Berntsen reaksiyası
Berntsen reaksiyası - diarlaminlərin karbotsiklik turşularla və ya onların törəmələri ilə turşu katalizi şəraitində kondensasiya yolu ilə 9-alkil və aril ilə əvəzlənmiş akridinlərin sintezi üsuludur.
Reaksiya ilk dəfə Avqust Berntsen tərəfindən 1878-ci ildə benzoy turşusunun nitrilin difenilamin ilə qarşılıqlı təsir reaksiya nümunəsindən istifadə edərək amidin xassələri üzərində təcrübə işi aparılmışdır. [1].
Daha sonra, bu metod katalizator kimi karbotsiklik turşuların sink xlorid və polifosfor turşusunun diarilaminləri ilə kondensasiyasından istifadə etməklə təkmilləşdirilmişdir [2].
== Reaksiyanın mexanizmi ==
Berntsen reaksiyasının mexanizmi uzun müddətdir müzakirə mövzusudur, əsasən reaksiyanın başlanğıc mərhələsinin iki alternativ yolu müzakirə olunur - diarlaminin N-asilasiyası, ardından amin qrupuna o-mövqedə molekul daxili C-asilasiya və ya birbaşa C-asilasiya. N-asillənmiş difenilaminlərin reaksiya şəraitində də akridinlər əmələ gətirdiyi göstərildi.Lakin N-asilatlı difenilaminlərin istifadəsi məhsulun miqdarını artırmadı; buna görə də hazırda birinci mərhələnin C-asilləşdirmə olduğuna inanılır. Polifosfor turşusu istifadə edildikdə və ya sink xlorid istifadə edildikdə kation əmələ gəlir [3]:
== Tədbiqi və dəyişikliklər ==
Berntsen sintezinin aparılması üçün klassik metod difenilamin qarışığının ekvivalent və ya artıq miqdarda aromatik və ya alifatik karbotsiklik turşu ilə və bir neçə saat ərzində bir həlledici olmadığı təqdirdə 1,5-3 qat molekulyar sink xloridlə qızmasıdır. Uçucu karbotsiklik turşular halında reaksiya möhürlənmiş ampulalarda aparılır; qarışqa turşusundan istifadə edilərkən əvəz olunmamış akridinin miqdarı son dərəcə aşağıdır.
Hidroksil ilə əvəz olunmuş difenilaminlər də sink xlorid ilə kataliz olunan reaksiyaya daxil olur, molekul daxili kondensasiya isə hidroksilin para-mövqeyinə keçir; məsələn, benzoil və 4-hidroksibenzoy turşusu ilə reaksiyalarda 3-hidroksidifenilamin yalnız 3-hidroksiakridinlər əmələ gətirir.
1960-cı illərdə Popp, eyni zamanda reaksiya və turşu ilə diarilamin 1: 2 nisbətində həlledici rolunu oynayan katalizator polifosfor turşusu kimi istifadə etməyi təklif etdi [2].

Butlerov reaksiyası
Butlerov reaksiyası (Formoz reaksiya) — kalsium kimi metal ionlarının iştirakı ilə zəif qələvinin sulu məhlullarında formaldehiddən müxtəlif şəkərlərin sintezi üçün avtokatalitik reaksiyadır. İlk dəfə 1861-ci ildə rus kimyaçısı Butlerov kəşf etmişdir.
== Reaktivlər və mexanizm ==
Butlerov sulu məhlulda formaldehidin təxminən 20 fərqli karbohidrogen qarışığı meydana gətirdiyini aşkar etdi. Reaksiya mexanizmi ilk dəfə Ronald Bres tərəfindən təklif edilmişdi. Formaldehid, müəyyən şərtlər daxilində iki valentli bir kationun iştirakı ilə, məsələn, kalsium ionu iştirakında kondensləşmə reaksiyası göstərərək glikolaldehid əmələ gətirir. Bu şərtlər daxilində qlikolaldehid dihidroksiasetona izomerləşə bilən qliseraldehidlə reaksiya daxil olur. Bu spirtlər reaksiyaya davam edərək tetrozlar, pentozlar və heksozlar əmələ gətirir. Reaksiya avtokatalitikdir, belə ki, spirt aldehidi ilk ilk mərhələdə kalsium ionu ilə kompleks əmələ gətirir.bu da formaldehiddən spirt aldehidin əməmlə gəlməsi üçün katalizatordur. Butlerov müxtəlif şəkərlərin rasemik qarışığı haqqında müəyyən məlumatlar verdi, lakin bildirdi ki, L-amin turşuları kimi birləşmələr D-konfiqurasiyalı karbohidrogenlərin əmələ gəlməsi üçün katalizatordur.
== Reaksiya ==
1959-cu ildə Ronald Breslou bir neçə əməliyyat mərhələsindən ibarət reaksiya mexanizmi təklif etdi: [2]
Reaksiya qlikolaldehid əmələ gətirən iki metanal molekulun kondensləşməsi ilə başlayır (1).

Favorski reaksiyası
Favorski reaksiyası - termiki alkinlərin karbonil qrupuna birləşməsi ilə 1 əvəz olunmuş propargil spirtlərinin sintezi üsuludur. Aleksey Favorski tərəfindən 1905-ci ildə fenil asetilenin ketonlarla kalium hidroksid iştirakı ilə qarşılıqlı təsirini öyrənərkən aşkar etmişdir [1] [2].
:
== Reaksiya mexanizmi ==
Reaksiya, 1-terminal alkinin asetilen anionunun karbonil qrupuna nükleofil əlavə edilməsi mexanizminə görə davam edir:
R
1
R
2
C
=
O
+
R
C
≡
C
−
→
R
1
R
2
C
(
O
−
)
C
≡
C
R
,
R
=
H
,
A
l
k
,
A
r
,
O
E
t
{\displaystyle {\mathsf {R^{1}R^{2}C{\text{=}}O+RC\equiv C^{-}\rightarrow R^{1}R^{2}C(O^{-})C\equiv CR,\ \ R=H,Alk,Ar,OEt}}}
Reaksiya ümumiyyətlə kalium hidroksid və ya natrium amidin həlledicidə (efir, benzol, dimetilformamid və s.) -70 ilə + 40 °C arasında olan temperaturda, az qaynayan birləşmələr və ya asetilen istifadə olunduqda - təzyiq 0.4-0, 9 MPa.təzyiqdə aparılır. Bəzi dəyişikliklərdə asetilen əvəzinə kalium hidroksidin iştirakı ilə kalsium karbid (asetilenid) istifadə olunur.
Məhsullar 40-60% -dir.
Ketonlar və bəzi aldehidlər reaksiyaya girir; alkin komponenti olaraq hər ikisi ilə əvəz olunmuş termik alkinlər (hetero-əvəzlənmişlər, məsələn etoksiasetilen [3] daxil olmaqla) və asetilen istifadə olunur. Sonuncu vəziyyətdə, meydana gələn 1,1-əvəzlənmiş propargil spirtlərinin deprotonlaşdırılması və onların karbonil birləşməsi, bis-adduktlar, asetilenik 1,4-diollarla qarşılıqlı təsiri nəticəsində də meydana gələ bilər:
R
1
R
2
C
=
O
+
H
C
≡
C
−
→
R
1
R
2
C
(
O
−
)
C
≡
C
H
{\displaystyle {\mathsf {R^{1}R^{2}C{\text{=}}O+HC\equiv C^{-}\rightarrow R^{1}R^{2}C(O^{-})C\equiv CH}}}
R
1
R
2
C
(
O
−
)
C
≡
C
H
+
B
−
→
R
1
R
2
C
(
O
−
)
C
≡
C
−
+
B
H
{\displaystyle {\mathsf {R^{1}R^{2}C(O^{-})C\equiv CH+B^{-}\rightarrow R^{1}R^{2}C(O^{-})C\equiv C^{-}+BH}}}
R
1
R
2
C
(
O
−
)
≡
C
−
+
R
1
R
2
C
=
O
→
R
1
R
2
C
(
O
−
)
C
≡
C
(
O
−
)
R
1
R
2
{\displaystyle {\mathsf {R^{1}R^{2}C(O^{-})\equiv C^{-}+R^{1}R^{2}C{\text{=}}O\rightarrow R^{1}R^{2}C(O^{-})C\equiv C(O^{-})R^{1}R^{2}}}}
Heksametilfosfotriamidin kalium hidroksidin ortaq həlledicisi kimi istifadəsi 1-əvəzedilmiş propargil spirtlərini 70% -ə qədər məhsulda sintez etməyə imkan verir. [4].
Favorski reaksiyasının aldehidlərə enantioselektiv əlavə edilməsinə imkan verən başqa bir dəyişiklik, yaş toluolda (+) - N-metilefedrin və trimetilamin iştirakı iləsink triflatın katalizator kimi istifadəsidir və bu vəziyyətdə məhsul Enantioselektivlik% 89-99%
Favorski reaksiyası dönən reaksiyadır. Əsas mühitində əvəz olunmuş propargil spirti termiki alkin və karbonil birləşməsinə parçalana bilər.

Henri reaksiyası
Genri (Henri) [1] reaksiyası - nitroaldol reaksiyası (ing. Henry reaksiyası, nitroaldol reaksiya) - aldehid və nitrometan arasındakı aldol tipli reaksiyadır. Nukleofil birləşmə mərhələsi əsaslarla katalizləşdirilir və turşu proton alfa vəziyyətində olduğu təqdirdə suyun eliminləşməsi ilə müşayiət edilə bilər. Henri reaksiyasının əsas məhsulları beta-hidroksi nitro birləşmələr, yan məhsulları isə nitroalkenlərdir (xüsusən aromatik aldegidlərdən istifadə edildiyi təqdirdə).
== Xüsusiyyətlər ==
Henri reaksiyasının xüsusiyyətləri [2]
Bütün reaksiyaları dönərdir;
Kifayət qədər gücü olan hər hansı bir əsas istifadə edilə bilər: qələvi metal hidroksidləri, karbonatlar, flüorid ionu mənbələri, polimer substratdakı əsaslar və s.;
Həlledici, adətən, böyük rol oynamır;
Beta-hidroksi nitro birləşməsi. adətən. iki diastereomerin qarışığı şəklində əmələ gəlir;Reaksiya şərtlərini dəyişməklə yaxşı diastereoselektrikliyə nail olmaq olar.
== Stereoselektivlik ==
Henri reaksiyasında iki yeni stereo mərkəz meydana gəldiyindən, 4-ə qədər də stereoizomer məhsulun meydana gəlməsi nəzəri cəhətdən mümkündür. Adətən, diastereomerlərin qarışığı alınır, baxmayaraq ki, xiral ligandlarının istifadəsi onlardan birinin (və ya bir neçə) çıxımını artıra bilər. Məsələn, sink triflat duzundan, əsasi diizopropiletilamindən (DIPEA) və (+) - N-metilefedrinin xiral ligandından (NME) ibarət katalitik sistem benzaldehid və nitrometanın enantioselektiv kondensasiya məhsulunu almağa imkan verir [3].

Hers reaksiyası
Hers reaksiyası -kimyaçı Riçard Hersin adını daşıyan Hers reaksiyası, anilin törəməsinin (1) disulfid dixlorid ilə Hers duzuna (2) kimyəvi çevrilməsidir, ardınca bu Hers duzu (2) natrium hidroksid ilə qarşılıqlı təsirdə olub natrium tiolata çevrilir (3):[1]
== Tətbiqi ==
=== Benzotiadiazollar ===
Hers duzları diazotizasiyaya uyğun olan aminotiofenolları almaq üçün hidrolizə uğradılaraq benzotiadiazolların sintezində istifadə olunur.[2]
=== Benzotiazollar ===
Natrium tiolat sink sulfatla aralıq maddə olan sink merkaptidinə çevrilə bilər, ardınca merkaptidin benzoil xloridlə reaksiyası ilə 1,3-benzotiazol alınır.
== Boyalar ==
Anilin (5) üç mərhələdə (6)-cı birləşməyə çevrilir;
1. Hers reaksiyası (anilin (5) və disulfid dixlorid) vasitəsilə orto-aminotiola çevrilmə, ardınca
2. Orto-aminoariltioqlikol turşusuna çevrilməsi və
3. Sandmeyer reaksiyası vasitəsilə aromatik amin radikalının nitrilə çevrilməsi.
4. Son mərhələdə nitril hidrolizə uğradılır və nəticədə (6) birləşməsi alınır. Bu bir-ləşmə həlqənin bağlanması reaksiyası və dekarboksilləşmə üsulu ilə (7) birləşməsinə çevrilir.
Alınmış birləşmə (tioindoksil(7)) bəzi boyaların üzvi sintezində mühüm aralıq məhsuldur. Asenaftoxinon ilə kondensasiyasından Ciba-Scarlet adlanan (8) boya, (7)-nin izatin ilə kondensasiyasından isə tio-İndiqo boyası (9) alınır.
Hevald reaksiyası
Hevald reaksiyası sərbəst kükürd iştirakı ilə gedən, aldehid və ya ketonun kondensləşməsi (burada R2=H) ilə nəticələnən əvəzolunmuş 2-aminotiofen alınan üzvi reaksiyadır.(aminotiofenlərin alınma reaksiyası)
== Tarixi ==
Reaksiya 1930 ildən Karl Hevaldın adını daşıyır.
Reaksiya mexanizmi kəşf olunduqdan 30 il sonra tədqiq edilmişdir. İlkin mərhələ aralıq məhsul (3) əmələ gətirən keton (1) və α-sianoefir (2) arasındakı Knyoevenagel kondensasiyasıdır.Sərbəst kükürdün əlavə edilməsi mexanizmi məlum deyil.Tsiklləşmə və tautomerləşmə lazım olan məhsulu verir:
Mikrodalğalı şüalanma reaksiya gedişinə və vaxtına təsir edir.
== Variantlar ==
Hevald reaksiyasının variantlarından birində 3-asetil-2-aminotiyofen dityandan (kükürd və asetonun əlavə olunması, R = CH 3 və ya asetaldehid, R = H olarsa) və sabit olmayan sianasetonun natrium duzundan başlayaraq sintez olunur. Aminotiyofenlərin çoxkomponentli sintezi (Gewald reaksiyası)
Gewald tərəfindən əvəzlənmiş 2-aminotiyofenlərin sintezi üçün çoxkomponentli metod
elementar kükürd, α-metil (metilen) karbonilin qarşılıqlı təsirindən ibarətdir.
== Mənbə ==
Коваленко, С. Н. Использование реакции Гевальда для синтеза 5-амино-3-метил-N-2-арилтиофен-2,4-дикарбоксамидов и N2-(арил)-5-амино-4-циано-3-метил-2-тиофенкарбоксамидов / С. Н. Коваленко, С. В. Власов, В. П. Черных // Журнал органічної та фармацевтичної хімії. - 2006. - Т. 4, вип. 3. - С. 43-46.

Knyovenagel reaksiyası
Knyovenagel reaksiyası - aldehidlərin və ya ketonların, əsas birləşmələri iştirakı ilə kondensləşməsidir. Reaksiya alman kimyaçısı Emil Knyovenagelin adını daşıyır.
Bu reaksiya məşhur Perkin reaksiyası ilə eyni modifikasiyadadır və oxşar mexanizm üzrə gedir.
Reaksiyanın birinci mərhələsi nukleofil birləşmə mexanizmi ilə gedir: birinci və ikinci növ amin əsasları aktiv olan metilen qrupundan proton ayırır.Əmələ gələn karbon ionu aldehid və ya ketonun karbonil qrupuna təsir edir və nəticədə su molekulları əmələ gəlir (Ona görə bu reaksiya Knyovenagel kondensasiyası). Adlanır. Nəticədə reaksiya məhsulu olaraq α , β gərginləşmiş ionlar alınır.
Aktiv olan metilen qrupu digər müəyyən formalarda iştirak edir [4]:.
Z-CH2-Z или Z-CHR-Z, məsələn dietilmalonat, turşu, ətilasetoasetat, malon turşusu vəya cianqarışqa turşusu[5].
Z-CHR1R2, məsələn nitrometanBurada Z-Hətta zəif əsasın ştirakında deprotonasiyanı asanlaşdırmaq üçün güclü olan elektoakseptor qrupdur. Qüvvətli əsasın katalizator kimi iştirakı arzuedilməzdir.

Kuçerov reaksiyası
Kuçerov reaksiyası — asetilen birləşmələrinin hidratlaşma reaksiyası ilə karbonil birləşmələrinin yaranmasıdır.
== Reaksiyalar ==
H
C
≡
C
H
+
H
2
O
→
H
g
S
O
4
,
H
+
C
H
3
C
H
O
{\displaystyle {\mathsf {HC\equiv CH+H_{2}O{\xrightarrow[{}]{HgSO_{4},H^{+}}}CH_{3}CHO}}}
C
6
H
5
C
≡
C
H
+
H
2
O
→
H
g
S
O
4
,
H
+
C
6
H
5
C
(
O
)
C
H
3
{\displaystyle {\mathsf {C_{6}H_{5}C\equiv CH+H_{2}O{\xrightarrow[{}]{HgSO_{4},H^{+}}}C_{6}H_{5}C(O)CH_{3}}}}
== Tarixi ==
İlk dəfə bu reaksiya 1881-ci ildə Rusiya kimyaçısı Mixail Qriqoryeviç Kuçerov tərəfindən kəşf edilmişdir. Kuçerov reaksiyasında katalizatorun zərərli təsiri səbəbindən ötrü hal-hazırda bu reaksiyadan istifadə edilmir. Kuçerov reaksiyasının əsasında Asetilendən Asetildehid almaq dayanır. Reaksiyanın katalizator kimi Civə (Hg2+) ionunun duzlarından istifadə edilir.

Mannix reaksiyası
Mannix reaksiyası və ya Mannixə görə aminometilləşmə reaksiyası - ammonyak, birli və ya ikili aminin və tərkibində heç olmasa bir mütəhərrik hidrogen atomu olan birləşmənin formaldehidlə kondensləşməsindən - Mannix adlanan əsasın əmələ gəlməsindən ibarətdir.
== Alınması ==
Əgər kondensasiyaya daxil olan birləşmədə iki və daha çox karbon atomlarında aktiv hidrogen atomları varsa, onda N−CH2- aminometil qrupları müxtəlif vəziyyətləri tutmaqla izomer qarışıqları əmələ gətirir. Ammonium duzu ilə reaksiya apardıqda, əksər hallarda əmələ gələn birli amin sonradan reaksiyaya girərək ikili və üçlü amin əmələ gətirir. Bundan başqa, ammonium duzunun formaldehidlə qarşılıqlı təsiri nəticəsində əmələ gələn metilamin reaksiyada iştirak etməklə onu çətinləşdirir.
== Tarixi ==
İlk dəfə Mannix tipli kondensasiyanı Tollens asetofenonun formaldehid və ammonium xloridlə reaksiya məhsulundan üçlü amini ayıran zaman müşahidə etmişdir. Sonralar, Petrenko-Kritçenko və onun əməkdaşları bu tipli kondensasiyanı öyrənmişlər, lakin onlar bu reaksiyanın ümumi xarakterini müəyyən edə bilməmişlər.
1917-ci ildə Mannix, antipirin salisilatın formaldehid və NH4Cl-lə qarşılıqlı təsirindən üçlü aminin əmələ gəlməsini müşahidə etməsi, başladığı tədqiqatlarına hərtərəfli təkan verdi. Belə ki, 4-dimetilaminoantipirin oxşar reaksiyaya girmədiyindən, tamamilə aydın olur ki, reaksiyada iştirak edən antipirin molekulunda 4 vəziyyətində olan hidrogen atomudur.
Baş verən çevrilmələrin dəqiq mexanizmi müəyyən edilməmişdir. Hazırda güman edilir ki, Mannix reaksiyası, CH2O və amindən əvvəlcə imin(ium) duzları , sonra isə amin törəmələri əmələ gəlməsilə baş verir.

Nitrolaşma reaksiyası
Nitrolaşma reaksiyası – üzvi birləşmələrə nitroqrupun (-NO2) müxtəlif üsullarla daxil edilməsi prosesinə deyilir. Karbohidrogen atomunda bir və ya bir neçə hidrogen atomun nitroqrup ilə əvəz olunmasıdan əmələ gələn birləşmələrə nitrobirləşmələr deyilir.
== Növləri ==
Nitroqrupun birləşdiyi karbohidrogen radikalından asılı olaraq nitrobirləşmələr 2 yerə bölünür: aromatik və alifatik nitrobirləşmələr.
== Tətbiq sahəsi ==
Aromatik nitrobirləşmələr çox böyük tətbiq sahələrinə malikdir. Onlardan boyaq sənayesində, dərman preparatları, partlayıcı maddələr və s. istehsalında istifadə olunur. Nitrobenzol əsasən (90%-ə qədər) anilin istehsalına, boyaların sintezinə (2%-ə qədər), və s. sərf olunur.
== Fiziki xassələri ==
Aromatik nitrobirləşmələr – rəngsiz və ya açıq sarı rəngdə yüksək temperaturda mayelərdir, ya da aşağı temperaturda əriyən bərk maddələrdir. Yüksək polyarlığına görə nitroarenlər yaxşı həlledicidirlər.

Nüvə reaksiyası
=== Radioaktiv Çevrilmə ===
Radioaktivlik 1896-cı ildə fransız alimi Anri Bekkerlium tərəfindən müəyyən edilmişdir. O qeyd etmişdir ki, uran saxlayan maddələr özlərindən görünməyən şüalar buraxır, bu da fotoplyonkanı işıqlandırır, ağacdan, kağızdan və bütün bərk maddələrdən keçə bilir. Bundan bir qədər sonra məşhur fransız fizikləri Mariya Skladovskaya-Kyüri və Pyer Kyüri müəyyən etdilər ki, «U»-dan əlavə «Th» torium və «Pa» planium eyni şüa buraxma qabiliyyətinə malikdir. 1898-ci ildə radium izotopu tapıldı. Aparılan müşahidələr göstərdi ki, radiumun verdiyi şüalanmanın ardıcıllığı, urandan milyon dəfə çoxdur. Bekkerli və Mariya Kyüri bir qədər sonra radiumun insan orqanizminə güclü təsirini müşahidə etdilər.
Dayanıqlığı az olan elementlərin atom nüvələri özbaşına parçalana bilir, bu zaman yeni element atomu nüvələri və radioaktiv şüalar adlanan xüsusi növlü şüalar əmələ gəlir. Bu hadisə radioaktivlik adlanır. Öz-özünə parçalanan izotop isə radioaktiv izotop adlanır.
Hazırda radioaktiv parçalanma zamanı yaranan şüalara ionlaşdırıcı və yaxud nüvə şüaları adı verilmişdir.

Pfitzinger reaksiyası
Pfitzinger reaksiyası (həmçinin Pfitzinger-Borşe reaksiyası kimi tanınır) - əvəzlənmiş xinolin-4-karbon turşuları əldə etmək üçün izatinlə əsas və aldehidin kimyəvi reaksiyasıdır.[1][2]
== Reaksiya mexanizmi ==
İzatinin kalium hidroksid kimi əsasla reaksiyası ketoturşunun (2) alınması üçün amid rabitəsinin hidrolizi baş verir. Bu aralıq məhsul təcrid oluna bilər, lakin adətən bu baş vermir. Keton (və ya aldehid) imin (3) və enaminin (4) alınması üçün anilin ilə reaksiyaya daxil olacaqdır. Enamin istənilən xinolinin (5) alınması üçün tsiklləşəcək və dehidratlaşacaq.
== Çevrilmə ==
== Halberkan variantı ==
N-asil izatinlərin əsaslarla reaksiyasından 2-hidroksi-xinolin-4-karbon turşuları alınır.[6]
== İstinadlar ==
^ Pfitzinger, W. (1886). "Chinolinderivate aus Isatinsäure". J. Prakt. Chem. (in German). 33 (1): 100.

Rozenmund reaksiyası
Rozenmund-Zayçev reaksiyasına - aldehid xloridlərin hidrogenlə aldehidlərə selektiv katalitik azaldılması reduksiyasına deyilir. Reaksiya 1872-ci ildə M.M.Zayçev tərəfindən kəşf edildi, klassik dəyişiklik 1918-ci ildə Rosenmund tərəfindən inkişaf etdirildi.
Katalizator metal paladium (BaSO4, CaCO3, BaCO3, asbest, kömür, diatomlu torpaq), bəzən Pt və Ni götürülür. Aldehidlərin reduksiya olunmasının qarşısını almaq üçün katalizatordan istifadə olunur. Həlledici (benzol, toluen və s.). katalizator, 80-180 °C-də, 150-200 °C-də buxar faza hidrogenləşmə istifadə olunur.. Alkoqollar, karbohidrogenlər və turşular tez-tez yan məhsullar kimi meydana gəlir [spirtlərdən və RC (O) Cl) əmələ gəlir.
Əsas aralıq məhsullar - spirtlər, karbohidrogenlər, turşular[spirtlərdən və RC (O) C1) əmələ gəlmişdir. Daha az və daha az miqdarda anhidridlər-t, oliqomerlər və polimerlər əmələ gəlir.
Rosemund şərtləri altında, dikarboktsilb turşu xloridlərindən to-t-ə qədər olan reaksiyalar.

Skraup reaksiyası
Skraup reaksiyası - Zdenko Hans Skraup adını daşıyır. Reaksiya tipi - tsiklin əmələ gəlməsi ilə gedən reaksiya.
Skraup sintezi xinolinləri sintez etmək üçün istifadə edilən kimyəvi reaksiyadır. Çexiyalı kimyaçısı Zdenko Hans Skraupun (1850-1910) şərəfinə adlandırılmışdır. Skraup reaksiyasında anilin sulfat turşusu, qliserin və nitrobenzol ilə qızdırılır və xinolin sintez edilir.[1][2][3][4]
Bu nümunədə nitrobenzol həm həlledici, həm də oksidləşdirici agent kimi iştirak edir. Əks halda şiddətli reaksiya olduğu üçün əsasən dəmir(II)sulfatın iştirakı ilə aparılır.[5] Nitrobenzol əvəzinə arsen turşusu istifadə edilə bilər və birincisi daha yaxşıdır, çünki reaksiya daha az şiddətlə gedir.[6]
== Həmçinin bax ==
Bisçler-Napieralski reaksiyası
Doebner-Miller reaksiyası
== İstinadlar ==
^ Skraup, Z. H. (1880). "Eine Synthese des Chinolins". Berichte. 13: 2086.
^ Manske, R. H. F. (1942).

Sonoqaşira reaksiyası
Sonoqaşıra reaksiyası - vinil və aril haloggenidlərin palladium və mis tərəfindən kataliz edilmiş terminal alkinlərlə çarpaz qoşulma reaksiyasıdır[1]. Bu reaksiya zamanı sp² halogen atomu ilə sp alkin atomu arasında bir karbon-karbon rabitəsi əmələ gəlir. Bunun digər çarpaz birləşmə reaksiyalarından fərqi ondadır ki, reaksiya substratlarından birinin - alkinin hər hansı bir metal üzvi birləşməsinə çevrilməsi üçün əvvəlcədən aktivləşdirilməsinə ehtiyac yoxdur. Sonoqaşıra reaksiyası kompleks molekulların sintezində xüsusilə vacib olan geniş funksional qrupların iştirakı ilə baş verə bilər [2] və geniş tətbiq sahəsi tapmışdır.
== Reaksiya şərtləri ==
Tipik reaksiya şərtləri Sonoqaşira tərəfindən 1975-ci ildə dərc edilmiş bir məqalədə 1,4-diiodobenzolun 0,5 mol miqdarında iştirakı ilə fenilasetilen ilə cüt ikiqat çarpaz birləşməsini misal gətirərək təsvir edilmişdir. % paladyum katalizatoru və 1 mol. dietilamində% mis yodid. Asetilenin iki terminal hidrogen atomunun iştirakı ilə ikiqatçarpaz birləşmə də təsvir edilmişdir [3].
== Mexanizm ==
Ümumiyyətlə Sonoqaşira reaksiyasının ikiqat katalitik tsikl ilə keçməsi qəbul edilir. Katalitik paladyum dövrü (dövrü A) Suzuki və Hek reaksiyalarındakı katalitik dövrlərə bənzəyir və köməkçi katalitik mis dövrü (dövrü B) asetilen qrupunun paladium atomuna keçməsini asanlaşdırır.

Sulfolaşma reaksiyası
Sulfolaşma reaksiyası – üzvi birləşmələrin molekuluna sulfoqrupun daxil etmə prosesinə deyilir.
== Aromatik karbohidrogenlərin sulfolaşması ==
Aromatik karbohidrogenlərin sulfolaşması reaksiyasında əsasən sulfat turşusu, oleum və SO3 – dən istifadə olunur. Sulfat turşusu ilə sulfolaşma prosesi dönən prosesdir:
ArH + H2SO4 → ArSO2OH + H2OAromatik karbohidrogenlərin sulfolaşması aromatik nüvədə tipik elektrofil əvəzetmə reaksiyasına aiddir. Reaksiya həm buxar, həm də maye fazada həyata keçirilir (həlledicilər: SO2, ССl4 və s.). Reaksiya ilkin turşuda olan və sulfolaşma reaksiyası zamanı alınan su ilə tormozlanır.
Güman edilir ki, aromatik nüvəyə birbaşa təsir edən agent SO2OH+ ionudur.
2H2SO4 ←→HSO4- + H3SO4+←→HSO4- + SO2OH + H2OSulfat turşusunun iştirakı ilə aparılan sulfolaşma prosesində əlavə məhsulların miqdarı çox az olur və əsasən də onun oksidləşdirici təsiri ilə müəyyən olunur.
== Aromatik birləşmələrin oleumla reaksiyası ==
Aromatik birləşmələrin oleumla reaksiyası iki mərhələdə baş verir.
Birinci mərhələ artıq olan sulfat anhidridinin çevrilməsi baş verir.
ArH+ H2SO4+SO3 ←→ ArSO2OH+H2SO4Bu reaksiya dönməyən və yüksək ekzotermikdir.

Vittiq reaksiyası
Vittiq reaksiyası- aldehidlərin və ya ketonların fosforilidləri və ya vittiq reaktivləri ilə kimyəvi reaksiyasıdır ki, bu da alken və ya alen və üçfenilfosfin oksid meydana gəlməsinə səbəb olur.
Reaksiya 1954-cü ildə Georg Vittiq tərəfindən aşkar edilmişdir. Bu reaksiyanın kəşfinə görə 1979-cu ildə kimya üzrə Nobel mükafatına layiq görülmüşdür.
Vittiq reaksiyası alkenlər əldə etmək üçün üzvi sintezdə geniş istifadə olunur [3] [4] [5].
== Reaksiyanın mexanizmi ==
Ilid 1-in karbonil birləşməsinə nukleofıl əlavə edilməsi nəticəsində betain 3 əmələ gəlir. Bu C-C rabitəsi ətrafında mərhələ 4-ə səbəb olan sərbəst fırlanma sayəsində baş verir. Sonuncu mərhələdə dörd üzvlü oksafosfetan halqa əmələ gətirərək sürətlə və əksinə olaraq izomerləşə bilər. (şəkil 5). Üçfenilfosfin oksidnin (formul 6) 7 formulu ilə qarşılıqlı reaksiyası formul 7- nin Z-izomerinin əmələ gəlməsinə səbəb olur.
Betain 4-ün oksafosfetan 5-ə izomerləşməsi reaksiya sürətini azaldır.

Vürs reaksiyası
Vürs reaksiyası və ya Vürts reaksiyası — metallik natriumun alkilhalogenlərə təsiri ilə simmetrik alkanların sintez metodudur. 1855-ci ildə fransız alimi Şarl Adolf Vürs tərəfindən tapılmışdır.

Zandmeyer reaksiyası
Zandmeyer reaksiyası - Diazoniyum qrupunun halogen anionu ilə (xlorid və bromid) və ya psevdohalogen (siyanid, tiosiyanat, azid və s.) əvəz olunması nəticəsində arenlərin əmələ gəlməsi reaksiyasıdır. Katalizator müvafiq olaraq birvalentli mis duzudur. Reaksiya 1884-cü ildə T. Zandmeyer tərəfindən kəşf edildi və ilk dəfə [1] -də nəşr olundu. Reaksiya sxemləri:
Sintez nümunəsi (toluidindən xlorotoluol) iş [2] -də dərc edilmişdir.
== Mexanizm ==
Politsiklik birləşmə reaksiyalarından fərqli olaraq elektron sıxlığı benzol törəmələrindən daha yüksək olan - naftalin, fenantren, bifenil və s. - Zandmeyer reaksiyası şəraitində aril halogenlərin məhsuldarlığı daha azdır; Bu vəziyyətdə katalizator olaraq birvalentli mismis duzları əvəzinə, ikiqat arildiazonium və civə halogenidlərinin termik parçalanması
Ar-N≡N + [HgHal3] - (Şvexten reaksiyası) istifadə olunur.
=== Nitrosonium ionunun əmələ gəlməsi ===
=== Benzenediazonium ionunun əmələ gəlməsi ===
=== Tək elektron ötürülməsi ===
Zandmeyer reaksiyasının digər bir variantı tetrafloroboratların arildiazonium duzlarının katalitik olmayan parçalanması nəticəsində florarenlərin sintezi reaksiyasıdır:
Ar-N ≡ N+ BF (Şiman reaksiyası)
== Mənbə ==
Дж. Дж. Ли. Именные реакции.

Ştaudinger reaksiyası
Ştaudinger reaksiyası — 1919-cu ildə German Ştaudinger tərəfindən kəşf edilmiş, azidlərin və fosfinlərin (və ya fosfitlərin) qarşılıqlı təsiri ilə fosfazenlərin (iminofosforanlar) sintezi üçün bir üsuldur [1] [2]:
R3P + R'N3
→
{\displaystyle \to }
R3P=NR' + N2Reaksiya nəticəsində əmələ gələn fosfazenlər sonrakı transformasiyalara daxil edilir. Beləliklə, amin və fosfin oksidin əmələ gəlməsinə səbəb olan fosfazenlərin hidrolizi, azidlərin aminlərə reduksiya olunması üçün bir metod kimi istifadə olunur (Ştaudinger reduksiyası):
R
3
P
=
N
R
1
+
H
2
O
→
R
1
N
H
2
+
R
3
P
=
O
{\displaystyle {\mathsf {R_{3}P{\text{=}}NR^{1}+H_{2}O\rightarrow R^{1}NH_{2}+R_{3}P{\text{=}}O}}}
Fosfazenlərin karbonil birləşmələri ilə qarşılıqlı təsiri iminlərin sintezi üçün bir metod kimi istifadə olunur (Ştaudingerə görə iminasiya):
R
3
P
=
N
R
1
+
R
2
2
C
O
→
R
2
2
C
=
N
R
1
+
R
3
P
=
O
{\displaystyle {\mathsf {R_{3}P{\text{=}}NR^{1}+R_{2}^{2}CO\rightarrow R_{2}^{2}C{\text{=}}NR^{1}+R_{3}P{\text{=}}O}}}
,İzosiyanatlar bir karbonil komponenti olaraq istifadə edildikdə, bu imitasiya karbodiimidlərin meydana gəlməsinə səbəb olur:
R3P=NR1 + R2N=C=O
→
{\displaystyle \to }
R2N=C=NR1 + R3PO
== Reaksiya mexanizmi ==
Reaksiya, fosfazidin əmələ gəlməsi ilə azid qrupunun son azot atomuna fosfinin nükleofil əlavə edilməsinə əsaslanır. Tsiklik bir aralıq əmələ gəldikdən və molekulyar azot məhv edildikdən sonra azin-ilid şəklində yük ayrılması ilə təqdim edilə bilən iminofosforan əmələ gəlir.
== Modifikasiya ==
2000-ci ildə K. Bertozzi qrupu, Ştaudinger reaksiyasının dəyişdirilməsini təklif etdi: [3], burada elektrofil tələ istifadə edildi , belə ki, amid və fosfin oksid əmələ gəlməsi ilə bir aza-ilid aralıq maddə kimi bir karbon turşusunun metil efiri əmələ gəlir. Adi Staudinger reaksiyasından fərqli olaraq, bu vəziyyətdə hər iki məhsul kovalent şəkildə əlaqələndirilir; bu səbəbdən bu modifikasiya "Staudingerligation" adlanır və kimyəvi biologiyada geniş istifadə olunur [4].
== Mənbə ==
StaudingerH., Meyer J. Über neue organische Phosphorverbindungen III. Phosphinmethylenderivate und Phosphinimine. (нем.) // Helv. Chem. Acta. — 1919.

Termonüvə reaksiyası
Termonüvə reaksiyası iki və ya daha çox atom nüvəsinin bir və ya daha çox fərqli atom nüvəsi və subatom hissəciklər (neytronlar və ya protonlar) yaratmaq üçün birləşdiyi reaksiyadır. Reaktivlər və maddələr arasındakı kütlə fərqi ya enerjinin sərbəst buraxılması və ya udulması kimi özünü göstərir. Kütlədəki bu fərq reaksiyadan əvvəl və sonra atom nüvələri arasında nüvə bağlama enerjisindəki fərqə görə yaranır. Nüvə sintezi aktiv və ya əsas ardıcıl ulduzları və böyük miqdarda enerjinin ayrıldığı digər yüksək miqyaslı ulduzları gücləndirən prosesdir.
Dəmir-56 və ya nikel-62- dən daha yüngül atom nüvələri yaradan nüvə birləşmə prosesi ümumiyyətlə enerji buraxır. Bu elementlər nisbətən kiçik bir kütlə və bir nuklon üçün nisbətən böyük bağlanma enerjisinə malikdirlər. Bunlardan daha yüngül nüvələrin birləşməsi enerji açır (ekzotermik proses), daha ağır nüvələrin birləşməsi isə məhsulun nuklonları tərəfindən saxlanılan enerji ilə nəticələnir və nəticədə yaranan reaksiya endotermik olur. Nüvə parçalanması adlanan tərs proses üçün bunun əksi doğrudur. Nüvə birləşməsində hidrogen və helium kimi daha yüngül elementlərdən istifadə edilir, bunlar ümumiyyətlə daha əriyəndir; uran, torium və plutonium kimi daha ağır elementlər isə daha çox parçalana bilirlər. Fövqəlnovanın həddindən artıq astrofiziki hadisəsi nüvələri dəmirdən daha ağır elementlərə çevirmək üçün kifayət qədər enerji istehsal edə bilər.

ARNDT-AYSTERT reaksiyası
ARNDT-AYSTERT REAKSİYASI — karbon turşusunun ən yüksək homoloq və ya onun törəməsinə çevrilməsi. Ardıcıl üç mərhələdə həyata keçirilir: turşunun hallogenhidridin alınması, diazoketon əldə etmək, diazoketonun o ya da onun törəməsinə yenidən çevrilməsi (Volf çevrilməsi):
və ya
Burada X ümumiyyətlə C1, daha az Br; Y = OH, OR ', NR'R ". Arndt — Eystert reaksiyası
Alifatik, alisiklik, aromatik və heterotsiklik karbin turşularına tətbiq olunur. Alifatik CH2N2 əvəzinə diazo birləşmələri 1037–51.jpg- əvəzlənmiş karbon turşuları və ya onların törəmələrinə gətirib çıxarır. Diazoketon hidrogen halogenidin aralıq birləşmə- diazonium halogeniidindən (F-la) ayrılması nəticəsində əmələ gəlir, bu da N2-dən ayrılaraq yan məhsul — xlorometil keton (II) əmələ gətirir (Nirenşteyn reaksiyası):
Reaksiyadan ayrılmış hidrogenhalogenid CH2N2 və ya trietilamin birləşməsi ilə əlaqələnir.
Arndt — Eystert reaksiyası, reduksiyaedici maddələrlə əlaqəli olmadığından, karbon turşusunun zəncirinin uzadılmasının digər metodlarından üstündür. Bunun sayəsində qalıq birləşmə, məsələn, nitro qrupu olan birləşmələr üçün istifadə edilə bilər. Arndt — Eystert reaksiyasının hər üç mərhələsindəki ümumi çıxım ümumiyyətlə 50–80% -dir. Metod hazırlıq məqsədləri üçün istifadə olunur.
Diazoketonların sintezi metodu 1927–28-ci illərdə F. Arndt, (Volf birləşməsindən stifadə edərək) bütövlükdə1935-ci ildə F. Arndt və B. Eistert tərəfindən hazırlanmışdır.

Angeli-Rumini reaksiyası
Angeli-Rimini reaksiyası aldehid ilə əsas mühitində sulfonamid N-hidroksibenzolsulfanamidlə reaksiyaından hidroksi turşunun əmələ gəlməsidir.
Digər bir reaksiya məhsulu sulfin turşusudur. Reaksiya iki İtalyan kimyaçısı Angelo Angeli və Enrico Rimini (1874-1917) tərəfindən aşkar edildi və 1896-cı ildə nəşr olundu.
Reaksiya aldehidləri dəmir xlor ilə birlikdə aşkar etmək üçün kimyəvi bir testdə istifadə olunur. Bu testdə aldehidi təsdiq edən bir neçə damla nümunə etanolda həll olunur, bir az natrium hidroksid məhlulu ilə birlikdə sulfanamid əlavə edilir və sonra həll Kongo qırmızıya qədər asidləşdirilir. Əlavə edilmiş dəmir xlorid damlası aldehidin iştirakı ilə məhlulu parlaq qırmızı rəngə çevirir. Sülfonamid, etanoldakı hidroksilamin və benzensülfonil xloridin kalium metal ilə reaksiyaya girərək əldə edilir
== Reaksiya mexanizmi ==
Bu reaksiyanın mexanizmi aydın deyil və bir neçə potensial yol var. N-hidroksibenzensülfonamid 1 və ya onun reduksiya forması 2, aralıq birləşmə 4 əmələ gətirmək üçün aldehid 3 ilə reaksiya verərək nükleofildir. 5 molekul içi proton mübadiləsindən sonra sulfin turşusu anyonu ayrılır və nitron 6 və ara maddə 7 vasitəsilə hidroksalmin turşu 8 əmələ gəlir. Alternativ olaraq, aziridin aralıq 9 birbaşa son məhsulu əmələ gətirir.

Baradin-Xunsdiker reaksiyası
Baradin-Xunsdiker reaksiyası (Rus ədəbiyyatında Borodin reaksiyası və İngilis dilində Xunsdiker reaksiyası olaraq da bilinir), karbon turşularının gümüş duzlarının halogenlərlə reaksiyasıdır və nəticədə halogenləşdirilmiş karbohidrogenlər meydana gəlir.
Reaksiya ilk dəfə 1861-ci ildə A. P. Borodin tərəfindən kəşf edilmişdir. Reaksiya mexanizmi 1942-ci ildə K. Xunsdiker tərəfindən ətraflı öyrənilmişdir.
== Reaksiya mexanizmi ==
Xunsdiker reaksiyasının mexanizmi sərbəst radikalların əmələ gəlməsi mərhələlərini əhatə edir. Karbon turşunun 1 gümüş duzu, bromla tez bir zamanda reaksiya girir və aralıq 2 (asilhipobromit) əmələ gətirir, bu da O-Br rabitəsinin homolizi nəticəsində radikal cüt yaranır. Asetil radikalının dekarboksilləşdirilməsindən sonra radikal cüt 4 rekombinasiyası tələb olunan üzvi halogenid verir.5
== Mənbə ==
Xunsdiker, C. et al. U. S. Patent 2,176,181.
Xunsdiker, H.; Xunsdiker, C. Chem. Ber. 1942, 75, 291.
Buvo-Blan reaksiyası
Buvo-Blan reaksiyası — Təsirsiz inert atmosfer mühitində mono və dikarbon alifatik turşuların natriumlu efirlərinin reduksiya olunması ilə α-hidroksiketonların (asilinlərin) əmələ gəlməsi.
== Tarixi ==
Bu reaksiyanı 1903-cü ildə L. Buvo və Q. Blan kəşf etmişdir.
=== Mərhələləri ===
Bir neçə mərhələdən ibarətdir:
Anion radikalın əmələ gəlməsi
Anionun meydana gəlməsi. Reaksiyanın son məhsulu protonlaşmadan sonra α-hidroksiketona (asilin) çevrilən 1,2-keton — enediolatdır1947-ci ildə A. Ştol və V. Preloq tərəfindən α, ω-dikarbon turşusunun diefirlərindən orta və böyük ölçüdə olan karbotsiklik birləşmələrin sintezini əldə edənə qədər bu reaksiya, üzvi kimyada öz tətbiqini tapmadı. Reaksiya, natrium və aralıq anionların oksidləşməsinin qarşısını almaq üçün argon cərəyanında incə səpələnmiş natriumla qarışdıraraq qaynayan ksilolda aparıldı. Bu halda kondensasiya əla məhsul verdi. Reaksiyanın məhsuldarlığını artırmaq üçün trimetilxlorsilandan istifadə olunur (Dikman kondensasiyasını məhv edir), bu vəziyyətdə əmələ gələn endiolların bis-trimetilsilil efirləri asanlıqla ayrılır və spirtlə qarşılıqlı təsir nəticəsində asilinlər əmələ gətirir. Bu, nəinki reaksiya çıxımını artırır, eləcə də aralıq prosesləri də minimuma endirməyə imkan verir.
== Mənbə ==
О. А. Реутов, А. Л. Курц, К. П. Бутин Органическая химия в 4-х частях, Изд.: "БИНОМ. Лабораторя знаний", М., 2004.
Ли Дж.
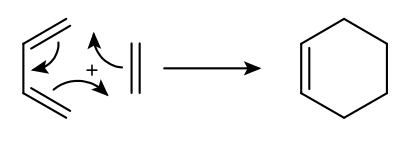
Dils-Alder reaksiyası
Dils-Alder reaksiyası
Furanın aromatikliyinin aşağı dərəcəsinə görə onun molekulu tez-tez birləşmiş dienin xüsusiyyətlərini nümayiş etdirir. Bu növün ən xarakterik çevrilməsi Diels-Alder dien sintez reaksiyasıdır, yəni. [4+2]-cycloading. Əslində furan və onun bir çox törəmələri, məsələn, malein anhidrid və dehidrobenzol ilə asanlıqla reaksiya verir.
Dils-Alder reaksiyası (dien sintezi) altı üzvlü halqa əmələ gətirmək üçün dienofillərin və birləşmiş dienlərin [4+2] sikloyüklənmə reaksiyasıdır.
Reaksiyaya siklik və asiklik birləşmiş dienlər, eninlər −C=C−C≡C− və ya onların heteroanaloqları — −С=С−С=О, −С=С−С≡N fraqmentləri olan birləşmələr daxil olur. Dienofillər adətən elektron çəkən əvəzedicilər tərəfindən aktivləşdirilən çoxlu bağa malik alkenlər və alkinlərdir. Dienofillər həmçinin heteroatomla qoşa bağları olan birləşmələr ola bilər, məsələn >C=O, >C=N−, -CN, -N=O, -S=O, -N=N− [1].
== Mexanizmi ==
Dils-Alder reaksiyası 1,3-dien və doymamış birləşmə, bir dienofil arasında baş verən uyğunlaşdırılmış [4+2]-sikyüklənmədir. Tipik olaraq, diendə elektron verən bir əvəzedici, dienofildə isə elektron çəkən bir qrup var.

Dyobner-Miller reaksiyası
Dyobner-Miller reaksiyası- nominal kimyəvi reaksiya, aromatik aminlərin hansı ki, məhlulda kondesləşmiş reagent kimi iştirak edən tərkibində sink xlorid və ya xlorid turşusu sərbəst orto-vəziyyətdə olan aldehid və ketonların tsiklokondensasiyası ilə xinolinin törəmələrinin alınma metodu. 1881-ci ildə alman kimyaçıları O.Dyobner və V.Miller tərəfindən kəşf edilmişdir. Reaksiya mexanizmi Skrayp reaksiya mexanizminə oxşardır
== Mexanizm ==
Reaksiya mexanizmi anilin və doymamış aldehid nümunəsi üçün verilmişdir.
Reaksiya əvvəlində anilin amino qrupu (1) ikiqat rabitəli C-C əlaqəsinə (C=C) hücum edir (2) Bu, enolat meydana gəlməsinə gətirib çıxarır (3).Hidrogen protonu amin qrupdan ayrılaraq enol qrupunun oksigeninə birləşir (4) Bundan sonra keton keto-enol tautomerizmi nəticəsində əmələ gəlir (5). Məhlulda olan hidrogen ionlarının təsiri ilə oksigen və azot atomları protonlaşır və qeri sabit ion(6) alınır ki, bu da molekuldaxili elektrofil birləşmə nəticəsində tərkibində iki tsikl olan maddə əmələ gətirir (7).O pratonu ayıraraq daha davamlı formaya keçir (8). Sonra qızdırıldıqda birləşmənin dehidratlaşması baş verərək ikiqat rabitəli əmələ gəlir (9).Reaksiya birləşmənin oksidləşməsi nəticəsində xinolin törəməsinin alınması ilə tamamlanır. Verilmiş konkret şəraitdə oksidləşdirici kimi elementar yod, havanın oksigeni və aromatik aminlə karbonil birləşməsinin qarşılıqlı təsiri nəticəsində Şiff əsaslı birləşmə ola bilər. [2][3].
Dyobner - Miller reaksiyasının mexanizmi Skrayp reaksiya mexanizminə yaxındır. Lakin fərqli cəhəti ondadır ki, göstərilmiş sintezdə doymamış karbonil birləşmələri fərqli bir şəkildə əmələ gəlir.

Haber-Veys reaksiyası
Haber-Veys reaksiyası- H2O2 (hidrogen peroksid) və superoksidin (• O2−) OH hidroksil radikalıdır. Reaksiya oksidləşdirici olaraq qəfəsdə baş verə bilər. Dəmir ionları katalizator olaraq iştirak edir və reaksiya kifayət qədər yavaş gedir. Reaksiyanın birinci mərhələsi Fe3+ -nın reduksiya olunması ilə başlayır:
Fe3+ + •O2− → Fe2+ + O2İkinci mərhələ:
Fe2+ + H2O2 → Fe3+ + OH− + •OHFe katalizatoru üçün ümumi reaksiya:
•O2− + H2O2 → •OH + OH− + O2Reaksiyanın adı Frits Haber və onun tələbəsi İosif Veysin şərəfinə adlandırılmışdır.
== Tarix ==
1931-ci ildə alman kimyaçısı və kimya üzrə Nobel mükafatçısı Frits Haber və tələbəsi İosif Veys Haber-Weiss reaksiyası adlanan zəncirvari reaksiyanı belə izah etmişlər:
(1) HO• + H2O2 → H2O + O2•- + H+
(2) O2•- + H+ + H2O2 → O2 + HO• + H2OLakin 1947-ci ildə Corc superoksid və hidrogen peroksid (2) arasındakı reaksiyanın superoksid parçalanmasının sürətli reaksiyasına nisbətən əhəmiyyətsiz olduğunu göstərdi:
(3) O2•- + H2O2 → OH− + HO• + O21949-cu ildə Veys bu dəlilləri qəbul etdi və Haber- Veys reaksiyası uzun müddət unuduldu. 1970-ci ildə Boşamp və Fridoviç superoksidin toksik təsirlərini izah etmək üçün unudulmuş bir reaksiyanı canlandırdılar, lakin 1970-ci illərdə aparılan laboratoriya tədqiqatları göstərdi ki, bu reaksiya üçün sürət sabitinin 1 M-1с-1 və ya daha az olması Corcun əvvəlki nəticələrini təsdiqlədi. Superoksid və hidrogen peroksid arasındakı reaksiyanın yenidən əhəmiyyətsiz olması təsdiqləndi və superoksidin toksikliyi Fentonun reaksiyasında öz əksini tapdı:
(4) Fe2+ + H2O2 → Fe3+ + HO- + HO•1994-cü ildə Kan və Keşa sərbəst oksigeni almaq məqsədilə Haber- Veys reaksiyasına müraciət etdilər. Hal-hazırda superoksidin toksikliyi Fenton reaksiyası ilə izah edilir.
== Mənbə ==
W. H. The Haber-Weiss cycle – 70 years later (неопр.) // Redox Report. — 2001.
Horner-Vadsvort-Emmons reaksiyası
Horner-Vadsvort-Emmons reaksiyası - Horner qrupunda aşkarlanan və altmışıncı illərin əvvəllərində Emmons qrupu tərəfindən inkişaf etdirilən reaksiya son illərdə çox populyarlıq qazandı. HVE reaksiyası- karbonil birləşmələrin (aldehidlər, bəzi ketonlar) alkilfosfan turşuların dialkil efirləri ilə qüvvətli əsasların iştirakında qarşılıqlı təsirindən alınan olefinlərin istehsalı deməkdir. Reaksiya yüksək seçiciliklə əvəz olunmuş trans-akril turşularının alınmasına imkan verir.
Bu reaksiyanın üstünlüyü ondadır ki, yüksək dərəcədə stabil və asanlıqla əldə olunan beşvalentli fosfor birləşmələrindən istifadə olunur. Fosfonatlardan alınan karbonionlar, Vittiq reaksiyasında istifadə olunan fosfor ilidlərdən daha çox nükleofil və reaksiya qabiliyyətlidir. Aralıq məhsullar kimi reaksiya nəticəsində yaranan dialil fosfonatlar su ilə işlədikdə asanlıqla xaric olunur.
Sxem və mexanizm:
saslar = BuLi, NaH, tert-BuOK, LiCl, NaNH2 ilə DBU.
həlledicilər = THF, benzol, asetonitril, 1,2-dimetoksietan (DME).
Elektron stereoelektivlik reaksiya şərtlərindən asılı olaraq çox dəyişir və aşağıdakı aralıqlarda artır:
Aldehid üzərində əvəzedicilərin artması ilə
Artan temperaturla (23 ° C> -78 ° C)
Li> Na> K duzu
DME> THF
Reaksiya mexanizmi yaxşı anlaşılmamışdır. Bütün mərhələlərin əhatə edildiyi güman olunur: bir fosfonatdan anionun yaranması, bir karbonil birləşməsinə əlavə edilməsi, ardınca fosfetana qədər aralıq tsikliləşmə və son olaraq bir alkenə aparan diaklil fosfonatın xaric edilməsi (Vittiq reaksiyasına bənzər).
== Mənbə ==
L.; Hoffmann, H. M. R.; Wippel, H. G. Chem.

Kijner-Volf reaksiyası
Kijner-Volf reaksiyası — Hidrazin və qələvinin(əsasən KOH) köməyi ilə keton qrupunun reduksiya olunması reaksiyasıdır:
İlkin olaraq reaksiya 200oC-də avtoklavda hidrozinin natrium etoksidlə qizdırılması ilə aparılır. Tədqiqatlar göstərir ki, reaksiya diger əsaslarla da aparıla bilər və bu zaman eyni reaksiya baş verəcəkdir. Həlledici olaraq dietilenqlikol istifadə edilir. Reaksiya alifatik, aromatik, alitsiklik və heterotsiklik birləşmələrə, terpenlərə, steroidlərə və həmçinin müxtəlif funksional qrupları olan maddələrə tətbiq olunur.
== Reaksiya mexanizmi ==
Reaksiya mexanizmi son mərhələdə karbonium anionunun xaric edilməsi ilə başa çatır:
Hidrazonlar əvəzinə, yarım karbazonlar və 2,4-dinitrofenilhidrazonlar da istifadə edilə bilər. Tert-C4H9OK və dimetil sulfoksiddən həlledici kimi istifadə edərək, reaksiya otaq temperaturunda aparıla bilər. Yan proseslər azinlərin meydana gəlməsi və alkoqollara qədər azalmasıdır.
Metodun üstünlükləri turşulara həssas olan birləşmələri bərpa etmək və çox miqdarda maddələrlə reaksiya aparmaq bacarığıdır (həlledicilər istifadə edildikdə). Kijner-Volf reaksiyasında yan proseslər — azin meydana gəlməsi və karbonil birləşməsinin azalması, artıq hidrazin istifadə edərək və reaksiyadan suyun çıxarılması, alkildiimid və karbanion meydana gəlməsidir:
== Mənbə ==
О. А. Реутов, А. Л. Курц, К. П. Бутин Органическая химия в 4-х частях, Изд.: "БИНОМ. Лабораторя знаний", М., 2004.
Ли Дж.
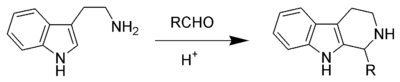
Piktet-Spenqler reaksiyası
Piktet-Spengler reaksiyası - β-aril- etilaminin aldehid və ya keton ilə kondensasiyaya məruz qaldığı və sonra həlqənin bağlandığı kimyəvi reaksiyadır. Reaksiya ilk dəfə 1911-ci ildə Amé Piktet və Teodor Spenqler (22 fevral 1886 - 18 avqust 1965) tərəfindən kəşf edilmişdir.[1] Ənənəvi olaraq protik həlledicidə turşu katalizatoru qızdırma zamanı istifadə olunurdu[2], lakin sonradan reaksiyanın aprotik mühitdə daha yüksək məhsuldarlıqla getdiyi öyrənilmişdir.[3] Piktet-Spenqler reaksiyasını Mannix reaksiyasının xüsusi halı hesab etmək olar. Bu reaksiyanın hərəkətverici qüvvəsi turş mühitdə aldehid və aminin kondensasiyası nəticəsində yaranan iminium ionunun elektrofilliyidir. Bu, əksər hallarda turşu katalizatoruna ehtiyacla izah edilir, çünki imin həlqəsi bağlanmaq üçün kifayət qədər elektrofil deyil, lakin iminium ionu bu reaksiyaya daxil olur.
Piktet-Spenqler reaksiyası həm sənayedə, həm də biosintezdə geniş istifadə olunur. Aşkar olunduğu gündən bəri alkaloid və üzvi sintez sahələrində əhəmiyyətli bir reaksiya olaraq qalmışdır, burada bir çox β-karbolinlərin alınmasında istifadə edilmişdir. Təbii Piktet-Spenqler reaksiyası adətən striktosidin sintaza kimi bir fermentindən istifadə edir. Bioloji xammal kimi amin turşusu triptofan və müxtəlif aldozalar istifadə olunur.
İndol və ya pirol kimi nukleofil aromatik həlqələr mülayim şəraitdə yüksək məhsul verir, fenil qrupu kimi daha az nukleofil aromatik həlqələr isə daha az məhsul verir və ya daha yüksək temperatur və qüvvətli turşu tələb edir. Piktet-Spenqler reaksiyası, tetrahidroizoxinolini meydana gətirən xlorid turşusunun katalizatorluğu ilə fenetilamin və dimetoksimetanın reaksiyasıdır.

Pomeranz-Fritiş reaksiyası
Pomeranz-Fritş reaksiyası- həmçinin Pomeranz-Fritş tsiklləşməsi adlanır, üzvi kimyaya aid reaksiyadır. Paul Fritş (1859-1913) və Casar Pomeranz (1860-1926) adlı alimlərin adını daşıyır.[1][2] Ümumiyyətlə, bu reaksiya izoxinolinin sintezidir.[2][3][4]
== Ümumi reaksiya sxemi ==
Aşağıdakı reaksiya benzaldehid və 2,2-dialkoksietilamindən izoxinolinin sintezini əks etdirir.[5]
Müxtəlif alkil qrupları, məsələn metil və etil qrupları əvəzedici (R) kimi istifadə edilə bilər. Reaksiyada sulfat turşusu proton donoru kimi (bəzən trifluorasetik anhidrid və lantanid triflatlar kimi Luis turşuları) istifadə olunurdu.[1][2][4] Daha sonra geniş çeşiddə müxtəlif izoxinolinlər uğurla sintez olunmuşdur.[4]
Əvvəlcə benzalaminoasetal benzaldehid və 2,2-dialkoksietilaminin kondensasiyası nəticəsində sintez olunur. Kondensasiyadan sonra alkoksi qruplarından birinə hidrogen atomu əlavə olunur. Bunun nəticəsində spirt alınır. Daha sonra, birləşmə 2 sintez olunur. Bundan sonra birləşməyə ikinci hidrogen atomu əlavə olunur. Son mərhələdə ikinci bir spirt alınır və bitsiklik aromatik birləşmə sintez olunur.
== Tətbiqi ==
Pomeranz-Fritş reaksiyası izoxinolin törəmələrinin sintezində geniş tətbiq olunur.
İzoxinolinlər bir çox sahədə tətbiq olunur, o cümlədən:[3][4]
• dimetisokin kimi yerli anesteziklər:
• vazodilatatorlar, tanınmış birləşmə papaverin aşağıda göstərilmişdir:
== Həmçinin bax ==
• Bişler-Napieralski reaksiyası
• Piktet-Spenqler reaksiyası
== İstinadlar ==
^ Jump up to:a b Pomeranz, C. (December 1893).