
Nitra
Nitra (slovak. Nitra, alm. Neutra) — Slovakiyanın qərbində şəhər. Əhalisi 88 minə yaxındır. Nitra, Nitra çayı vadisində, Tribeç dağ massivinin yamacında yerləşir. Nitra bölgəsinin inzibati mərkəzidir.
== Əhali ==
== Qalereya ==
== Məşhur nitralılar ==
Henrich Benčík (* 1978), futbolçu
Ivana Bojdová (* 1985), futbolçu
Igor Demo (* 1975), futbolçu
Renáta Filová (* 1981), futbolçu
Vilmos Fraknói (1843-1924), tarixçi
Stanislav Hudec (* 1982), hokkeyçi
Monika Katonová (* 1989), futbolçu
Ľubomír Kolník (* 1968), hokkeyçi
Tomáš Kóňa (* 1984), futbolçu
Wilhelm Viktor Krausz (1878–1959), rəssam
Anton Lehmden (* 1929), rəssam və qrafik ustası
Jan Ivan Lelley (* 1936), mikoloq
Monika Matysová (* 1981), futbolçu
František Mikloško (* 1947), Politik
Dušan Milo (* 1973), hokkeyçi
Jan Mojto (* 1948), Mediameneceri və Filmprodüsseri
Ľubomír Moravčík (* 1965), futbolçu
Štefan Ružička (* 1985), hokkeyçi
Stefan Schwartz (1851-1924), Venalı medalist
Miroslav Stoch (* 1989), futbolçu
Jozef Stümpel (* 1972), hokkeyçi
Leopold Szondi (1893-1986), psixiatr
== Qardaşlaşmış şəhərlər ==
İspaniya Qvadalaxara
Polşa Keltse
Serbiya Baçki-Petrovats
Çexiya Çeske-Budeyoviçe
Avstraliya Qosford
Çexiya Kromerjij
ABŞ Nepervill
Xorvatiya Osiek
Slovakiya Spişska Nova Ves
Polşa Zelyona-Qura
Niderland Zutermer
== İstinadlar ==
== Xarici keçidlər ==
Internetseite der Stadt Nitra
NitraLive!

Nitra FK
Nitra — Slovakiya futbol klubu.
== Tarixi ==
"Nitra" klubu 1909-cu ildə yaradılıb. Bu komandanın ölkə çempionatlarında ən böyük uğuru iki dəfə bürünc medal qazanmasıdır. "Nitra" bu uğurlara 1962-ci ildə Çexoslovakiya, 2008-ci ildə isə Slovakiya çempionatında "imza atıb". Komanda iki dəfə avrokuboklarda qüvvəsini sınayıb. İlk dəfə 1989-1990-cı illər mövsümündə UEFA kubokuna qatılan "Nitra" Almaniyanın "Köln" klubuna hər iki oyunda məğlub olub. 2006-2007-ci illər mövsümündə İntertoto kubokunun ilk mərhələsində Lüksemburqun "Qrevanmaher" klubunu iki oyunda darmadağın edən "Nitra" ikinci mərhələdə "Dnepr"i keçə bilməyib. 2008-2009-ci illər mövsümündə isə sonuncu İntertoto kubokunun ilk mərhələsində Neftçi Bakı klubuna məğlub olaraq mübarizəni dayandırıb.
== Mənbə ==
"Nitra" necə klubdur?

Nitra bölgəsi
Nitra diyarı (slovak. Nitriansky kraj) — Slovakiyada birinci dərəcəli inzibati–ərazi vahidlərindən biri. Diyarın inzibati mərkəzi Nitra şəhəridir. Sahəsi 6343 km², əhalisi isə 713 422 nəfər (2001) təşkil edir.
Nitra diyarı Slovakiyanın cənub-qərbində yerləşir. Diyar cənubda Macarıstan ilə həmsərhəddir.
== İnzibati bölünmə ==
Nitra diyarı "okres" adlanan 7 rayona bölünür:
Komarno rayonu
Levitse rayonu
Nitra rayonu
Nove Zamki rayonu
Şalya rayonu
Topolçanı rayonu
Zlate Moravtse rayonu
== Coğrafiya ==
Diyar Slovakiyanın cənub-qərbində, Ortadunay düzənliyinin şərqində yerləşir. Fiziki-coğrafi olaraq, diyarı iki regiona bölünür: Dunay düzənliyi və Jitnı adası cənubda, Dunay yüksəkliyi isə şərqdə və mərkəzdə yerləşir. Diyarın ərazisində həmçinin Povajski İnovets (şimal-qərbdə), Tribeç (Nitra şəhərindən şimalda), Pohronski İnovets (şimal-şərqdə) və Ştyavnitske Vrhi dağ massivləri yerləşir. Diyar ərazisindən axan əsas çaylar - Dunay, Qron, Vaq, Nitra və İpeldir.

Nitra diyarı
Nitra diyarı (slovak. Nitriansky kraj) — Slovakiyada birinci dərəcəli inzibati–ərazi vahidlərindən biri. Diyarın inzibati mərkəzi Nitra şəhəridir. Sahəsi 6343 km², əhalisi isə 713 422 nəfər (2001) təşkil edir.
Nitra diyarı Slovakiyanın cənub-qərbində yerləşir. Diyar cənubda Macarıstan ilə həmsərhəddir.
== İnzibati bölünmə ==
Nitra diyarı "okres" adlanan 7 rayona bölünür:
Komarno rayonu
Levitse rayonu
Nitra rayonu
Nove Zamki rayonu
Şalya rayonu
Topolçanı rayonu
Zlate Moravtse rayonu
== Coğrafiya ==
Diyar Slovakiyanın cənub-qərbində, Ortadunay düzənliyinin şərqində yerləşir. Fiziki-coğrafi olaraq, diyarı iki regiona bölünür: Dunay düzənliyi və Jitnı adası cənubda, Dunay yüksəkliyi isə şərqdə və mərkəzdə yerləşir. Diyarın ərazisində həmçinin Povajski İnovets (şimal-qərbdə), Tribeç (Nitra şəhərindən şimalda), Pohronski İnovets (şimal-şərqdə) və Ştyavnitske Vrhi dağ massivləri yerləşir. Diyar ərazisindən axan əsas çaylar - Dunay, Qron, Vaq, Nitra və İpeldir.
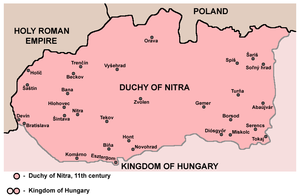
Nitra knyazlığı
Nitra knyazlığı (slovak. Nitrianske kniežatstvo, Nitriansko, Nitrava; mac. Nyitrai Fejedelemség), həmçinin Nitra hersoqluğu — siyasi mərkəzi Nitra şəhərində cəmləşən, müasir Slovakiya ərazisində yerləşən qərbi slavyan knyazlığı. VIII əsrdə yaranmışdır. IX əsrin əvvəllərində knyazlığın ərazisi müasir Slovakiyanın demək olar ki, bütün ərazisini (Zaqorye istisna olmaqla), həmçinin Zakarpatiyanın və şimal-şərqi Macarıstanın bir hissəsini əhatə edirdi. 833-cü ilə qədər knyazlıq öz müstəqilliyini saxlamış, sonra Nitra knyazı Pribina Moraviya böyük knyazı I Moymir tərəfindən qovulmuş və knyazlıq Böyük Moraviyanın tərkibinə daxil edilmişdir. 907–925-ci illərdə Böyük Moraviyanın süqutundan sonra knyazlıq Macarıstan knyazlığının tərkibinə daxil edilmişdir. 1108-ci ildə Nitra knyazlığı öz suverenliyini itirmişdir.

Ammonium nitrat
Ammonium nitrat – NH4NO3 kimyəvi birləşmədir, nitrat turşusunun duzudur.
== Tarixi ==
İlk dəfə 1659-cu ildə İohan Qlauber tərəfindən kəşv edilmişdir.
== Fiziki xassələri ==
Ammonium nitrat ağ kristal maddədir. Suda çoxyaxşı həll olur: 100 q buzlu (oC) suda 118,3 qram, 20oC-də 192 qram, 30oC-də 241,8 qram, 50oC-də 384 qram, 80oC-də 580 qram, 100oC-də 871 qram. Həmçinin, ammonium nitrat ammonyak, piridin, metanol, etanolda həll olunur. Detonasiyanın sürəti 2570 m/s.
Normal atmosfer təzyiqində NH4NO3 kristalları üçün bir neçə modifikasiya mövcuddur. Adi şəraitlərdə rombik kristallik qəfəs stabildir. O, 32,2oC-dən yuxarı temperaturda digər rombik, parametrləri kəskin dəyişmiş formaya keçir. 82,2oC-dən yuxarı temperaturda tetraqonal, 125,8oC-dən yuxarı temperaturda kubik forma stabildir.

Berilium nitrat
Berilium nitrat - Be(NO3)2 formuluna malik kimyəvi birləşmədir. Berilium və nitrat turşusunun orta duzudur.
== Fiziki xassələri ==
Berilium nitrat – bərk kristal maddədir. Suda yaxşı həll olunur (107 q/100 ml 20 0C –də).
Birləşmə müxtəlif tərkibli kristalhidratlar şəklində mövcuddur. Qatı HNO3 əlavə edildikdə Be(NO3)2•4H2O və ya [Be(H2O)4](NO3)2) tetrahidrat sulu məhlullardan ayrılır. Be(NO3)2•3H2O trihidrat (xüsusilə 54% HNO3 olan məhlullardan kristallaşır) və Be(NO3)2•2Н2O dihidrat da məlumdur.
== Alınması ==
Berilium nitratı berilium oksid və ya berilium hidroksidin nitrat turşusu ilə və ya mübadilə
reaksiyası zamanı almaq olar:
B
e
O
+
2
H
N
O
3
⟶
B
e
(
N
O
3
)
2
+
H
2
O
{\displaystyle {\mathsf {BeO+2\ HNO_{3}\longrightarrow \ Be(NO_{3})_{2}+H_{2}O}}}
B
e
(
O
H
)
2
+
2
H
N
O
3
⟶
B
e
(
N
O
3
)
2
+
2
H
2
O
{\displaystyle {\mathsf {Be(OH)_{2}+2\ HNO_{3}\longrightarrow \ Be(NO_{3})_{2}+2H_{2}O}}}
B
e
S
O
4
+
B
a
(
N
O
3
)
2
⟶
B
e
(
N
O
3
)
2
+
B
a
S
O
4
{\displaystyle {\mathsf {BeSO_{4}+Ba(NO_{3})_{2}\longrightarrow \ Be(NO_{3})_{2}+BaSO_{4}}}}
== Kimyəvi xassələri ==
Berilium nitrat digər nitratlar kimi mübadilə reaksiyalarının əksəriyyətinə daxil olur. Qələvi metalların karbonatları, sulfidləri və ammonium ilə reaksiyaya daxil olaraq berilium hidroksid alınır:
B
e
(
N
O
3
)
2
+
N
a
2
S
+
2
H
2
O
⟶
B
e
(
O
H
)
2
+
H
2
S
+
2
N
a
N
O
3
{\displaystyle {\mathsf {Be(NO_{3})_{2}+Na_{2}S+2H_{2}O\longrightarrow Be(OH)_{2}+H_{2}S+2NaNO_{3}}}}
B
e
(
N
O
3
)
2
+
N
a
2
C
O
3
+
H
2
O
⟶
B
e
(
O
H
)
2
+
C
O
2
+
2
N
a
N
O
3
{\displaystyle {\mathsf {Be(NO_{3})_{2}+Na_{2}CO_{3}+H_{2}O\longrightarrow \ Be(OH)_{2}+CO_{2}+2NaNO_{3}}}}
Berilium nitrat sulu məhlullarda qismən hidrolizə uğrayır və əsası nitrat alınır:
B
e
(
N
O
3
)
2
+
H
2
O
⟷
B
e
(
O
H
)
N
O
3
+
H
N
O
3
{\displaystyle {\mathsf {Be(NO_{3})_{2}+H_{2}O\longleftrightarrow Be(OH)NO_{3}+HNO_{3}}}}
1000 0C –də termiki parçalanma baş verir və berilium oksid,oksigen, azot oksidləri alınır:
2
B
e
(
N
O
3
)
2
⟶
2
B
e
O
+
4
N
O
2
+
O
2
{\displaystyle {\mathsf {2Be(NO_{3})_{2}\longrightarrow \ 2BeO+4NO_{2}+O_{2}}}}
== Tətbiqi ==
Əvvəllər, elektrik işıqlandırmanın geniş yayılmadığı dövrdə berilum nitratı, qaz ilə işləyən lampaların qapaqlarını hazırlamaq üçün istifadə edirdilər.
== İstinadlar ==
Неорганическая химия.

Dəmir (III) nitrat
Dəmir (III) nitrat - qeyri-üzvi kimyəvi birləşmə, azot turşusu və üç valentli dəmirin duzudur.
== Fiziki xassələri ==
Dəmir (III) nitrat adi temperaturda konsentra-siyadan asılı olaraq Fe(NO3)3•6H2O tərkibli rəngsiz kublar şəklində və ya Fe(NO3)3•9H2O tərkibli monoklinik kristallar kimi kristallaşır.
Fe(NO3)3• 6H2O - kub qəfəsli açıq bənövşəyi rəngli hiqroskopik kristallardı. Ən azı tərkibində 57% HNO3 və 28% Fe(NO3)3 olan sulu məhlullardan kristallaşdıqda alınır.
Fe(NO3)3• 9H2O - monoklinik qəfəsli çox higroskopik açıq bənövşəyi kristallardı (a = 0,140 nm, b = 0,970 nm, c = 1,103 nm, β = 95,52°C). Suda yaxşı həll olunur, qızdırıldıqda 50,1 0C-də əriyir.
== Alınması ==
Dəmir (III) nitratı dəmir qırıntılarının 20-30% -li nitrat turşusunun məhlulu ilə reaksiyası zamanı almaq olar:
F
e
+
4
H
N
O
3
⟶
F
e
(
N
O
3
)
3
+
2
H
2
O
+
N
O
↑
{\displaystyle {\mathsf {Fe+4HNO_{3}\longrightarrow Fe(NO_{3})_{3}+2H_{2}O+NO\uparrow }}}
İstehsalatda bu prosesi məhluldan hava üfürməklə həyata keçirmək olar:
4
F
e
+
12
H
N
O
3
+
3
O
2
⟶
4
F
e
(
N
O
3
)
3
+
6
H
2
O
{\displaystyle {\mathsf {4Fe+12HNO_{3}+3O_{2}\longrightarrow 4Fe(NO_{3})_{3}+6H_{2}O}}}
Laboratoriya şəraitində dəmir (III) nitratı mübadilə reaksiyası zamanı almaq olar:
F
e
2
(
S
O
4
)
3
+
3
B
a
(
N
O
3
)
2
⟶
2
F
e
(
N
O
3
)
3
+
3
B
a
S
O
4
↓
{\displaystyle {\mathsf {Fe_{2}(SO_{4})_{3}+3Ba(NO_{3})_{2}\longrightarrow 2Fe(NO_{3})_{3}+3BaSO_{4}\downarrow }}}
C
e
(
N
O
3
)
3
O
H
+
3
H
N
O
3
+
F
e
S
O
4
⟶
C
e
(
N
O
3
)
3
+
F
e
(
N
O
3
)
3
+
H
2
S
O
4
+
H
2
O
{\displaystyle {\mathsf {Ce(NO_{3})_{3}OH+3HNO_{3}+FeSO_{4}\longrightarrow Ce(NO_{3})_{3}+Fe(NO_{3})_{3}+H_{2}SO_{4}+H_{2}O}}}
== Kimyəvi xassələri ==
Sulu məhlullarda dəmir (III) nitrat güclü hidrolizə məruz qalır:
F
e
(
N
O
3
)
3
+
2
H
2
O
⇄
F
e
(
O
H
)
2
N
O
3
+
2
H
N
O
3
{\displaystyle {\mathsf {Fe(NO_{3})_{3}+2H_{2}O\rightleftarrows Fe(OH)_{2}NO_{3}+2HNO_{3}}}}
HNO3 məhlulunu güclü turşulaşdırmaqla tarazlığı əks istiqamətə dəyişmək olar.
2
F
e
(
N
O
3
)
3
+
6
N
a
O
H
+
(
n
−
6
)
H
2
O
⟶
F
e
2
O
3
⋅
n
H
2
O
↓
+
6
N
a
N
O
3
{\displaystyle {\mathsf {2Fe(NO_{3})_{3}+6NaOH+(n-6)H_{2}O\longrightarrow Fe_{2}O_{3}\cdot nH_{2}O\downarrow +6NaNO_{3}}}}
Dəmir (III) nitrat qızdırıldıqda parçalanır:
4
F
e
(
N
O
3
)
3
→
t
2
F
e
2
O
3
+
12
N
O
2
↑
+
3
O
2
↑
{\displaystyle {\mathsf {4Fe(NO_{3})_{3}{\xrightarrow {\ t\ }}2Fe_{2}O_{3}+12NO_{2}\uparrow +3O_{2}\uparrow }}}
== Tətbiqi ==
Dəmir (III) nitrat çirkab suların təmizlənməsində koaqulyant kimi, parçaların və yunların rənglənməsi zamanı (rəng tez yuyulmasın) istifadə olunur.
Dəmir (III) nitratla hopdurulmuş bəzi gillər üzvi sintezdə faydalı oksidləşdirici lərdir.
2
N
H
3
+
2
N
a
→
F
e
(
N
O
3
)
3
2
N
a
N
H
2
+
H
2
{\displaystyle {\mathsf {2NH_{3}+2Na{\xrightarrow {Fe(NO_{3})_{3}}}2NaNH_{2}+H_{2}}}}
== İstinadlar ==
Волков А. И., Жарский И. М. Большой химический справочник.

Kalium nitrat
Kalium nitrat (KNO3) - qeyri -üzvi bir birləşmədir, nitrat turşusunun kalium duzudur.
== Təbiətdə tapılması ==
Təbiətdə nitrokalit mineralı kimi tanınır. Təbii kalium nitrat azot tərkibli maddələrin parçalanması nəticəsində tapılır. Bitkilərdə və heyvanlarda çox az miqdarda olur.
== Fiziki xassələri ==
Suda yaxşı həll olunur, orta dərəcədə qliserində, maye ammonyakda, hidrazində, təmiz etanolda və efirdə həll olunmur.
== Alınması ==
Gübrənin çürüməsi nəticəsində azot əmələ gəlir və saman qatlarında toplanaraq nitrifikasiyaya məruz qalır və əvvəlcə azotlu, sonra isə nitrat turşusuna çevrilir. Nitrat turşusu əhəngdaşı ilə qarşılıqlı təsir göstərərək, su ilə yuyulmuş Ca(NO3)2 alınırdı. Odun külünün əlavə edilməsi CaCO3 çökdürdü və kalium nitrat məhlulu əmələ gətirdi. Çox zaman əhəng daşı əvəzinə yığına dərhal kül əlavə edilir və kalium nitrat alınır.
C
a
(
N
O
3
)
2
+
K
2
C
O
3
⟶
2
K
N
O
3
+
C
a
C
O
3
↓
{\displaystyle {\mathsf {Ca(NO_{3})_{2}+K_{2}CO_{3}\longrightarrow 2\ KNO_{3}+CaCO_{3}\downarrow }}}
1854-cü ildə alman kimyaçısı K. Nöllner daha əlverişli və daha ucuz kalium xlorid və natrium nitratın reaksiyasına əsaslananaraq kalium nitrat istehsal etdi:
K
C
l
+
N
a
N
O
3
⟶
K
N
O
3
+
N
a
C
l
{\displaystyle {\mathsf {KCl+NaNO_{3}\longrightarrow KNO_{3}+NaCl}}}
Kalium nitratın alınmasının bir neçə başqa yoluda var.

Nitralloy
Nitralloy (alloy— qatışıq, ərinti) — azotlanmış detalların hazırlanması üçün işlədilən konstruksiya poladları qrupunun ümumi adı.
Nitralloydakı əsas legirləyici elementlər Al, Cr, Mo, V xırda kristallik bərk nitridlər əmələ gətirmr, həmin birləşmələr azotlanan səth qatına yüksək bərklik (HV 1200-dək) və yeyilməyə dözümlülük xüsusiyyətləri verir.

Nitraria
Şorgilə (lat. Nitraria) — sabunağacıçiçəklilər sırasının şorgiləkimilər fəsiləsinə aid bitki cinsi.

Nitrariaceae
Şorgiləkimilər (lat. Nitrariaceae) — i̇kiləpəlilər sinfinin sabunağacıçiçəklilər sırasına aid bitki fəsiləsi.

Nitrat turşusu
Nitrat turşusu (HNO3) – birəsaslı, qüvvətli turşu.
Adi şəraitdə rəngsiz mayedir. Kimya sənayesinin ən mühüm məhsullarından biridir. Susuz Nitrat turşusunun sıxlığı 1,522 q/sm3-dir, —41°C-də donur, 86°C-də qaynayır. Su ilə istənilən nisbətdə qarışır və azeotrop qarıqiıq əmələ gətirir.
İki kristalhidratı məlumdur: HNO3·H2O və HNO3·3H2O. Susuz nitrat turşusu davamlı deyildir, adi temperaturda işıqda parçalanaraq oksigen çıxarır (4HNO3=4NO2-2H2O + O2). Nitrat turşusu qüvvətli oksidləşdiricidir, kükürdü sulfat turşusuna çevrilincəyə qədər oksidləşdirir, yalnız qızıla, tantala və platin fəsiləsinin bəzi metallarına təsir etmir. Metallarla reaksiyaya girib azot 2-oksid çıxarır. Durulaşdırılmış nitrat turşusunda asan həll olan bəzi metallar, məsələn, dəmir, xrom, alüminium, metalın səthində qoruyucu oksid təbəqəsi əmələ gətirdiyi üçün qatı nitrat turşusuna qarşı davamlıdır. Bu xüsusiyyət qatı nitrat turşusunu polad qablarda saxlamağa və daşımağa imkan verir.
Nitratlar
Nitratlar — minerallar, azot turşusunun (HNO3) duzları. Quruluş və bəzi xassələrinə görə (məsələn: ikiqat şüasındırma) karbonatlara yaxındır. Bəzən nitratlar həmin sinfə daxil edilir. Nitronatritlə kalsit, nitrokalitlə araqonit arasında müşahidə edilən izotipiya bu qohumluğu aydın göstərir. Lakin olduqca güclü turşu duzları kimi, bir sıra xassələrinə (xüsusən yüksək həllolma və aşağı sərtlik), həmçinin mənşəyinə görə nitratlar karbonatlardan kəskin fərqlənir. Nitratlar məhz ekzogen proseslər zamanı, adətən, üzvü qalıqların parçalanması və bakteriyaların fəaliyyəti nəticəsində əmələ gəlir. Şimşək çaxdıqda elektrik boşalmaları nəticəsində NO2 əmələ gəlməsi də ehtimal edilir. Nitratlar olduğca dayanıqsız olub yalnız quru iqlim şəraitində rast gəlir. Ən güclü əsasların (Na və K) nitratları daha səciyyəvidir.
== Mənbə ==
Geologiya terminlərinin izahlı lüğəti.

Qallium nitrat
Qallium nitrat — mineral, alümoşpinellər qrupu. Qrupun digər mineralları (şpinel, hersinit, qalaksit) ilə izomorf sıralar yaradır. Al qismən Fe3+, Cr, Mn3+ ilə əvəz olunur. Kubik kristalları oktaedrik, yaxud dodekaedrik. İkiləşmə şpinel qanunu {111} üzrə olur. Ayrılma {111} üzrə qeyri-mükəmməl. Aqreqat: tək-tək dənələr. Tünd-yaşıl, bozumtul-yaşıl, göyümtül-qara, bəzən sarı və ya qonur. Cizgisi boz, bozumtul-yaşıl. Parıltı: şüşəli, yağlı.