



















* azərbaycan dilinin orfoqrafiya lüğətində mövcuddur
* Sözün müxtəlif mətnlərdə yazılışı.
























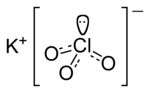
1 is. [yun. chloros – yaşımtıl-sarı] Texnikada, sanitariyada – zərərsizləşdirici, hərbi işlərdə isə zəhərləyici maddə kimi işlədilən yaşımtıl-sarı rəngli boğucu kimyəvi maddə – qaz.
Azərbaycan dilinin izahlı lüğəti / xlor1 I сущ. хлор (химический элемент, удушливый газ зеленовато-желтого цвета с резким запахом; используется как отравляющее и обеззараживающее средство). хим. Təbii xlor природный хлор, süni xlor искусственный хлор, xlordan zəhərlənmə отравление хлором II прил. хлорный (относящийся к хлору). Xlor iyi хлорный запах
Azərbaycanca-rusca lüğət / xlor